Кроме понятия «работа изменения объема», в термодинамических расчетах широко используют понятие «работа изменения давления».
Работой изменения давления называется работа перемещения жидкостей, газов и паров из области высокого давления (![]() ) в область низкого давления (
) в область низкого давления (![]() ). Ее значение определяют либо по формулам:
). Ее значение определяют либо по формулам:
![]() , (6.7)
, (6.7)
![]() , (6.8)
, (6.8)
либо графически, пользуясь ![]() -диаграммой.
-диаграммой.
Здесь W – работа изменения давления; V – средний объем; w – удельная работа изменения давления; v – средний удельный объем.
Графически удельная работа изменения давления определяется площадью 1234 на ![]() -диаграмме (рис. 6.3), ограниченной осью ординат и двумя абсциссами , проведенными из крайних точек линии процесса.
-диаграмме (рис. 6.3), ограниченной осью ординат и двумя абсциссами , проведенными из крайних точек линии процесса.
В результате замены этой площади (пл.) равновеликой ей площадью прямоугольника 3456 высотой, равной разности ![]() , и основанием, равным среднему удельному объему газа (v) в процессе, устанавливаем, что
, и основанием, равным среднему удельному объему газа (v) в процессе, устанавливаем, что
пл. 1234 = пл. 3456 = ![]() .
.
Работа изменения давления положительная, если ![]() >
> ![]() , и отрицательная, если
, и отрицательная, если ![]() <
< ![]() .
.
Найдем связь между удельными работами изменения объема (l) и изменения давления (w). Пусть на ![]() -диаграмме линия 1 – 2 изображает процесс произвольного состояния рабочего тела (рис. 6.4). В этом случае пл. 1234 (заштрихованная вертикальными линиями) графически изображает удельную работу изменения объема (l) ,а пл. 1256 (заштрихованная горизонтальными линиями) – удельную работу изменения давления (w).
-диаграмме линия 1 – 2 изображает процесс произвольного состояния рабочего тела (рис. 6.4). В этом случае пл. 1234 (заштрихованная вертикальными линиями) графически изображает удельную работу изменения объема (l) ,а пл. 1256 (заштрихованная горизонтальными линиями) – удельную работу изменения давления (w).
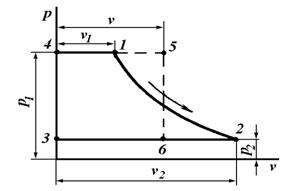
Рис. 6.3. PV-диаграмма
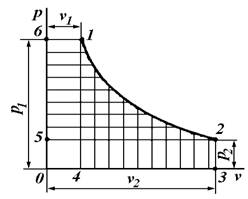
Рис. 6.4. PV-диаграмма
Из рисунка 6.4 видно что
пл. 1234 + пл. 6140 – пл. 5032 = пл. 6125
или
![]() ,
,
откуда
![]() . (6.9)
. (6.9)
После подстановки удельной работы изменения объема, определенной по формуле (6.9), в уравнение первого начала термодинамики (6.2) имеем:
![]() .
.
Сгруппируем слагаемые последнего выражения следующим образом:
![]() . (6.10)
. (6.10)
Введем обозначение:
![]() .
.
Величина h называется удельной энтальпией, и поскольку ее определяют три параметра состояния, то и сама она является параметром состояния.
Подставив значения h в формулу (6.9) ,получим еще один вид уравнения первого начала термодинамики:
![]() . (6.11)
. (6.11)
Значения удельной энтальпии определяют по справочникам.
Физический смысл величины h можно выяснить путем исследования уравнения (6.11), записанного в дифференциальной форме:
![]() .
.
При p = const имеем:
![]() ,
,
т.е. dh есть элементарное количество теплоты, подведенное к термодинамическому телу в процессе при постоянном давлении.