Рассмотрим теперь экстракцию хелатов (внутрикомплексных соединений). По движущей силе процесса ее можно отнести к ассоциативному виду. Типичным примером является экстракция дитизоната цинка. Раствор соли цинка находится в водной фазе, реагент (дифенилтиокарбазон) в инертном разбавителе (хлороформе) составляет экстрагент. Схема экстракционных равновесий выглядит следующим образом:
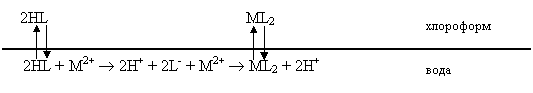
С константами равновесия:
![]() ;
; ![]() .
.
![]() ;
; ![]() .
.
Поскольку ![]() , как правило, очень большая величина, то [ML2]®0, и уравнение для коэффициента распределения принимает следующий вид:
, как правило, очень большая величина, то [ML2]®0, и уравнение для коэффициента распределения принимает следующий вид:
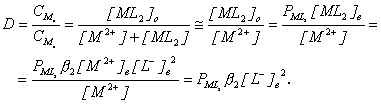
Таким образом, коэффициент распределения при экстракции хелата пропорционален концентрации реагента в органической фазе, обратно пропорционален концентрации ионов водорода в водной фазе и не зависит от концентрации металла.
Если мы создадим большой избыток реагента в органической фазе, а концентрация металла в водной фазе будет много меньше ее, то [НL]o = СHL орг = const, и тогда коэффициент распределения будет зависеть только от рН водной фазы. Нетрудно видеть, что D при какой-то кислотности водной фазы может быть равен единице, т.е. будет извлекаться ровно половина имеющегося металла:
![]() .
.
Если D = 1, тогда lgD = 0 и ![]() . Следовательно, в точке D = 1 система не зависит от концентрации, а положение этой точки на шкале рН определяется исключительно значением константы. Называют ее точкой половины экстракции и используют для характеризации процессов экстракции хелатов различных металлов.
. Следовательно, в точке D = 1 система не зависит от концентрации, а положение этой точки на шкале рН определяется исключительно значением константы. Называют ее точкой половины экстракции и используют для характеризации процессов экстракции хелатов различных металлов.
Экстракция хелатов чрезвычайно широко распространена в аналитической химии. В качестве растворителей чаще всего используют: неполярные или малополярные жидкости, четыреххлористый углерод, хлороформ, бензол, керосины и т.п. Реагентами служат обычно органические молекулы, содержащие донорные атомы серы, азота, кислорода и других элементов.
Попробуем теперь выяснить, как нужно организовать процесс, чтобы экстрагироватъ соединение с чисто ионным характером связи, т.е. соединение, которое полностью диссоциирует как в водной, так и в органической средах. Для того чтобы такое соединение переходило из водной фазы в органическую, необходимо, чтобы потеря энергии при дегидратации ионов была скомпенсирована выигрышем энергии при сольватации ионов молекулами органического растворителя. Этого проще всего добиться, когда энергия гидратация ионов мала, что, в свою очередь, требует, чтобы катион и анион имели большие размеры и малый заряд.
В органическом растворителе при заданных параметрах ионов энергия сольватации будет расти пропорционально диэлектрической проницаемости среды: чем выше она, тем больше энергия сольватации. В идеале диэлектрическая проницаемость органической фазы должна быть близкой к диэлектрической проницаемости воды, и тогда электростатические составляющие гидратации и сольватации будут равны. Но, как правило, органические фазы имеют меньшую диэлектрическую проницаемость. Если нам необходимо экстрагировать крупный анион, например, МnO4- или ReО4-,то в качестве партнера следует выбрать один из следующих катионов: Рh4As+, Рh4Sb+, Рh4Р+ или Bu4N+. Отметим, что в растворителях с высокой диэлектрической постоянной избирательность извлечения падает. И, тем не менее, такие процессы позволяют отдалять анионы однозарядные от двух и трехзарядных.
Можно ли этот вид систем использовать для экстракции катионов, имеющих малый радиус и высокий заряд? Совершенно очевидно, что прямой подход не принесет успеха, необходимо катион так модифицировать, чтобы он стал большим и углеводоподобным.
Одним из способов модификации ктиона в процессе экстракции является превращение аквоиона в комплексный катион, в котором молекулы воды замещены большими органическими молекулами. Так, аквоион железа(II) можно превратить в крупный катионный комплекс с a,a’-дипиридилом или 1,10-фенантролином. После такой модификации этот катион с подходящим анионом можно извлечь в органическую фазу. Действительно, перхлорат железа не экстрагируется, но перхлорат трифенантролиноферроата умеренно извлекается хлороформом и довольно хорошо нитробензолом.
Второй способ модификации – это превратить катион в однозарядный анионный комплекс и использовать для его извлечения какой-либо крупный катион. Очень часто в качестве катиона в этом случае используют катионы красителей.
Экстракция крупных ионных пар и экстракция хелатов при количественном описании оказываются совершенно идентичными. В этом нет ничего удивительного, поскольку используются однотипные уравнения. Принципиальное различие заключается в природе сил, которые заставляют частицы переходить в органическую фазу. При экстракции хелатов природа органического растворителя не играет никакой роли, так как они почти одинаково экстрагируются самыми разнообразными классами экстрагентов. Экстракция же ионных пар сильно зависит от природы растворителя, чем выше его диэлектрическая проницаемость, тем больше коэффициент распределения.