Одним из методов комплексообразования, получившим большое распространение в титриметрии, является комплексонометрия. В ее основе лежит образование прочных растворимых комплексов (хелатов) при взаимодействии ионов металлов с производными аминополикарбоновых кислот (комплексонами).
Из большого числа комплексонов в титриметрическом анализе особенно широко используется этилендиаминтетрауксусная кислота (H4Y). Сама кислота малорастворима в воде, поэтому применяют ее двунатриевую соль (ЭДТА), растворимость которой достаточно велика. ЭДТА количественно и стехиометрично реагирует с ионами металлов. Сухой препарат ЭДТА просто получить в чистом виде, а его раствор устойчив в течение длительного времени. ЭДТА обычно приготавливается как раствор вторичного стандарта из дигидрата двунатриевой соли этилендиаминтетрауксусной кислоты, который может содержать 0,3 %-й избыток влаги по отношению к указанной стехиометрии.
Молекула Н4Y содержит четыре способных к диссоциации атома водорода – два относительно сильнокислотных и два слабокислотных (рК1а = 2,00; рК2а = 2,67; рК3а = 6,16; рК4а = 10,26). В результате, рН среды оказывает сильное влияние на состоя
ние H4Y в растворе, а, следовательно, и на полноту комплексообразования ЭДТА с металлами.
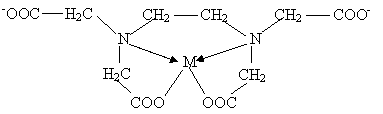 Будучи полидентатным лигандом, этилендиаминтетраацетат-ион с ионами практически всех металлов дает прочные комплексы состава 1 : 1 независимо от заряда катиона. ЭДТА может действовать как четырех-, пяти- и шестидентатный лиганд, так как кроме четырех карбоксильных групп –СОО- содержит два атома азота, каждый из которых имеет неподеленную пару электронов. Например, строение комплекса М(II)Y2- с координационным числом четыре (КЧ = 4) можно схематично изобразить следующим образом:
Будучи полидентатным лигандом, этилендиаминтетраацетат-ион с ионами практически всех металлов дает прочные комплексы состава 1 : 1 независимо от заряда катиона. ЭДТА может действовать как четырех-, пяти- и шестидентатный лиганд, так как кроме четырех карбоксильных групп –СОО- содержит два атома азота, каждый из которых имеет неподеленную пару электронов. Например, строение комплекса М(II)Y2- с координационным числом четыре (КЧ = 4) можно схематично изобразить следующим образом:
Образование комплексов ЭДТА с металлами в зависимости от рН среды описывается уравнениями:
![]() , рН = 3…5;
, рН = 3…5;
![]() , рН = 7…9;
, рН = 7…9;
![]() , рН ³ 11.
, рН ³ 11.
Константы устойчивости (КМY) комплексов металлов с ЭДТА, приведенные в справочниках, относятся к равновесию:
![]()
и имеют вид:
![]() .
.
Вследствие того, что полнота комплексообразования сильно зависит от кислотности среды, комплексонометрические титрования проводят обычно при постоянном рН. Часто процесс титрования осложняется осаждением части определяемого иона в виде основных оксидов и гидроксидов при рН, необходимом для проведения титрования. Чтобы этого избежать, необходимо ввести вспомогательный комплексообразующий реагент. Определения, которые необходимо вести в слабощелочной среде, обычно проводят в аммиачных буферах с подходящим значением рН и необходимой концентрацией комплексообразователя – аммиака.
При расчетах в комплексонометрии нужно пользоваться условными константами устойчивости (K”MY), учитывающими протекание в растворе конкурирующих реакций: комплексообразования иона металла с компонентами буфера и протонизации этилендиаминтетраацетат-иона:
![]() ,
,
где aм – доля металла, незакомплексованного с компонентами буфера и другими лигандами; aY – доля депротонированного реагента Y4-; [M’] – суммарная равновесная концентрация всех присутствующих в растворе форм металла за исключением комплексов металла с ЭДТА; [Y’]- суммарная равновесная концентрация всех присутствующих в растворе форм ЭДТА за исключением комплексов ЭДТА с металлом.
Доля металла, незакомплексованного с компонентами буфера и другими лигандами определяется по формуле:
![]() ,
,
а доля депротонированного реагента Y4- - по формуле:
![]() .
.
Доля депротонированного реагента aY (табл. 8.1) зависит от значения рН и констант диссоциации H4Y:
![]() .
.
Таблица8.1
Величины aY для H4Y в растворах с различными значениями рН
|
рН |
aY |
рН |
aY |
|
2,0 |
3,7.10-14 |
8,0 |
5,4.10-3 |
|
3,0 |
2,5.10-11 |
9,0 |
5,2.10-2 |
|
4,0 |
3,6.10-9 |
10,0 |
3,5.10-1 |
|
5,0 |
3,5.10-7 |
11,0 |
8,5.10-1 |
|
6,0 |
2,2.10-5 |
12,0 |
9,8.10-1 |
|
7,0 |
4,8.10-4 |
13,0 |
1,0 |
Доля металла aM является обратной величиной функции Ледена (Фм). Функция Ледена учитывает образование комплексов металла с компонентами буфера (например, в аммиачном буфере с аммиаком и гидроксид-ионами) и другими лигандами, которые могут присутствовать в растворе (например, маскирующие реагенты):
![]() ,
, ![]() ,
,
где bi, bj – общие константы устойчивости комплексов с лигандами L и ОН-.
Если в условиях титрования aМ=1, то условная константа образования комплекса металла с ЭДТА обозначается K’MY и равна
![]() .
.
Кривые комплексонометрического титрования строят в координатах рМ – D. Размер интервала, внутри которого происходит резкое изменение рМ, и положение точки эквивалентности определяются значением условной константы устойчивости комплекса металла с ЭДТА, концентрациями титруемого вещества и титранта.
Все дальнейшие расчеты будем рассматривать для случая равных аналитических концентраций титруемого вещества и титранта (с0), с учетом разбавления растворов.
На ход кривой комплексонометрического титрования до точки эквивалентности (D < 1) оказывает влияние присутствие в растворе постороннего комплексообразователя. Чем концентрация вспомогательного реагента больше, тем меньше aм и, соответственно, скачок титрования меньше:
![]()
или
![]() .
.
Значение рН среды влияет на форму кривой титрования в области за точкой эквивалентности (D > 1). Чем кислее среда, тем меньше aY и К"MY, соответственно, меньше скачок титрования:
.
Оба фактора определяют положение точки эквивалентности. Для точки эквивалентности можно записать следующие равенства:
![]() ,
, ![]() .
.
Подставляя концентрации в условную константу, получаем
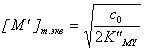 и
и 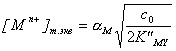 .
.
Рассмотрим, каково должно быть значение К"MY в условиях титрования, чтобы погрешность за счет неполноты связывания металла в комплекс с ЭДТА в точке эквивалентности была меньше 0,1 %. Пусть 99,9 % от исходного количества металла перешло в комплексонат в точке эквивалентности. Тогда имеем:
![]() ,
, ![]() .
.
Подставляя концентрации в выражение для условной константы, получим, что она должна удовлетворять условию:
![]() .
.
Таким образом, при титровании 0,010 М растворов ошибка титрования за счет неполного протекания реакции не превышает 0,1 %, если значения условных констант устойчивости комплексов металлов с ЭДТА больше 2 · 108.
Конечную точку титрования в комплексонометрии устанавливают с помощью металлохромных индикаторов. Металлохромные индикаторы – это вещества, которые образуют с ионами титруемых металлов достаточно прочные растворимые комплексные соединения, отличающиеся по окраске от цвета свободного индикатора и менее устойчивые, чем комплексы металлов с ЭДТА.
Большинство металлоиндикаторов обладает способностью присоединять протоны и образовывать соединения, окрашенные почти так же, как и комплексы металлов. Поэтому они являются кислотно-основными индикаторами и пригодны в качестве металлоиндикаторов только в той области рН, где конкурирующая реакция с участием протонов отсутствует.
Таким образом, в конечной точке титрования происходит разрушение окрашенных комплексов металла с индикатором с образованием бесцветных комплексов металла с ЭДТА и высвобождением имеющего другую окраску свободного индикатора.
Процесс комплексообразования иона металла с индикатором характеризуется константой устойчивости (КМInd). При расчетах в комплексонометрии в случае присутствия посторонних комплексообразователей или лигандов следует пользоваться условными константами устойчивости. По определению, условная константа устойчивости комплекса металла с индикатором равна:
![]() ,
,
где aInd – доля депротонированного индикатора Indm-, [Ind’] – суммарная равновесная концентрация всех присутствующих в растворе форм индикатора за исключением комплексов индикатора с металлом.
Если в условиях титрования aM = 1, то пользуются условной константой устойчивости комплекса металла с индикатором:
![]() .
.
Для того чтобы правильно фиксировать точку эквивалентности, нужно брать такой индикатор, у которого интервал изменения окраски попадает в интервал резкого изменения рМ титруемого раствора. Подобрать индикатор и рассчитать индикаторную ошибку титрования в каждом конкретном случае можно, только построив теоретическую кривую титрования.
При правильно выбранном индикаторе, когда конец титрования практически совпадает с точкой эквивалентности, даже при относительно невысоких значениях условных констант образования комплексов металла с ЭДТА (lgК"MY ³ 6) можно получить вполне приемлемые результаты. И, наоборот, при неудачно выбранном индикаторе даже при образовании очень прочных комплексов металлов с ЭДТА результаты могут оказаться неудовлетворительными.
Рассмотрим, как правильно выбрать индикатор. Пусть изменение цвета титруемого раствора происходит, когда 50 % исходного количества комплексов металла с индикатором разрушилось, т.е. [МInd]к.т = [Ind’]к.т. В этом случае концентрация металла в конечной точке титрования равна:
![]() ;
;
![]() . (8.2)
. (8.2)
Пусть конечная точка титрования совпадает с точкой эквивалентности, т.е. [Мn+]к.т = [Мn+]т.экв. Подставляя в формулу (8.2) вместо концентраций металла выражения для их расчета, получим:
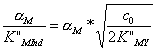 .
.
Конечная точка титрования будет совпадать с точкой эквивалентности, если взять индикатор, для которого в условиях титрования К”Мind удовлетворяет равенству
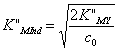 .
.
Например, если с0 = 0,010М и K”MY = 2 · 108 (что соответствует 99,9 % связыванию металла в комплекс с ЭДТА в точке эквивалентности), то индикатор будет менять окраску в точке эквивалентности, если K”MInd=2 · 103.