Рассчитать растворимость сульфата бария в растворе, в литре которого содержится 0,01 моль сульфата натрия.
Одноименным к иону осадка является сульфат-ион. Поэтому растворимость BaSО4 вычисляеем исходя из концентрации ионов бария:
![]() ,
,
где [SO42-] – избыточная концентрация одноименного иона.
Значит,
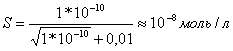 .
.
Растворимость сульфата бария в присутствии сульфата натрия уменьшается, по сравнению с растворимостью его в воде, в 1000 раз.
Растворимость солей, образованных анионами слабых кислот, зависит от рН раствора, так как изменение содержания ионов водорода в растворе оказывает влияние на диссоциацию слабых кислот и, следовательно, на концентрацию аниона осадителя.
Влияние гидролиза на растворимость солей также учитывается с помощью правила произведения растворимости. Если величина ПР осадка мала, концентрацией ОН--ионов, образующихся при гидролизе аниона, можно пренебречь. Расчет растворимости осадка за счет гидролиза катиона не имеет большого практического значения в весовом анализе и в данном пособии не рассматривается.
При расчете растворимости солей, подвергающихся гидролизу по катиону и аниону, можно считать, что рН в системе равен 7, если ПР достаточно мало. В этом случае доля негидролизованного катиона приблизительно равна доле негидролизованного аниона.