Универсальным приемом устранения мешающего действия является разделение компонентов. Эта операция встречается очень часто, к тому же теоретические основы методов разделения разработаны достаточно хорошо. Для успешного выполнения этой операции, прежде всего, необходимо, чтобы система была гетерогенной. Напомним некоторые понятия и определения.
Системой называют тело или группу тел, находящихся во взаимодействии и мысленно обособляемых от окружающей среды. Гомогенной называется такая система,
внутри которой нет поверхностей раздела, отделяющих друг от друга части системы, различающиеся по свойствам. Системы же, внутри которых такие поверхности раздела имеются, называются гетерогенными.
Термином «фаза» обозначается совокупность всех гомогенных частей системы, одинаковых по составу, химическим и физическим свойствам и ограниченных от других частей системы некоторой поверхностью раздела. Компонентом или составной частью системы называется каждое из содержащихся в ней химически однородных веществ, которое может быть выделено из нее и может существовать в изолированном виде.
Итак, в общем виде задача по разделению компонентов сводится к выделению их в различные фазы: твердую, жидкую или газообразную. Одним из самых общих законов физической химии является закон равновесия фаз, называемый правилом Фаз. Оно формулируется следующим образом: число степеней свободы равновесной термодинамической системы (Q), на которую из внешних факторов влияют только температура и давление, равно числу независимых компонентов системы (К) минус число фаз (Ф) плюс два:
![]() .
.
Под степенью свободы понимают независимое условие (температуру, давление, концентрацию), которое можно произвольно менять, не изменяя этим числа или вида фаз системы.
Условием равновесия между двумя фазами в отношении распределения между ними какого-либо компонента служит равенство химического потенциала этого компонента в обеих фазах:
![]() .
.
Если к раствору серной кислоты добавить раствор хлористого бария, то выпадает осадок сульфата бария. Система гетерогенна и состоит в основном из двух фаз: твердого осадка и жидкого раствора. Распределение сульфата бария между твердым веществом и раствором будет происходить до тех пор, пока химический потенциал BaSO4 в осадке не станет равным химическому потенциалу его же в растворе.
Условие межфазного равновесия можно выразить в другой форме, более доступной пониманию аналитика, не прибегая к понятию химического потенциала, используя Закон распределения Бертло-Нернста.
До сих пор мы ни словом еще не обмолвились о том, как образуется осадок. А вопрос этот не очень простой. Итак, каков же механизм образования осадка?
Наиболее интересным явлением при образовании осадков является наличие индукционного периода, т.е. после смешения реактивов осадок появляется не мгновенно, а через некоторый промежуток времени. Величина индукционного периода может быть самой разнообразной и выражается следующим эмпирическим уравнением:
![]() ,
,
где tинд – продолжительность индукционного периода; С0 – начальная концентрация; n – эмпирическая константа.
По данным электропроводности можно сделать вывод, что во время индукционного периода только очень небольшая часть вещества находится в виде ионных пар или более крупных образований. Величина индукционного периода сильно зависит от чистоты реактивов и посуды. Это заставляет думать, что в большинстве случаев кристаллизация начинается на посторонних центрах: на частичках пыли, стенках сосуда и т.п. Исследование индукционного периода привело к выводу, что появление осадка происходит только в том случае, когда в растворе достигается определенная степень пересыщения. Если величина критической степени пересыщения не достигнута, то при ус
ловии очень чистых реактивов, идеальной посуды и лабораторного помещения, осадок может не появляться неопределенно долгое время.
Итак, эти наблюдения говорят о том, что образование осадка проходит через стадию образования зародышей или центров кристаллизации. При исследовании процессов кристаллизации большое внимание уделяют гранулометрическому составу осадка, т.е. определению числа и размера образовавшихся частиц осадка. Здесь было выяснено, что гранулометрический состав сильно зависит от концентрации реагентов, причем иногда можно так проводить осаждение, что осадок будет однородным и состоять он будет из небольшого числа крупных правильно ограненных кристаллов. Это подтверждает ту мысль, что образование осадка идет на некоторых центрах. Очевидно, что гранулометрический состав осадка определяется относительной скоростью двух процессов:
1) образованием центров кристаллизации;
2) ростом центров кристаллизации.
Пересыщенный раствор метастабилен, термодинамически неустойчив, однако он может оставаться в гомогенном состоянии бесконечно долго, до тех пор, пока в него не введут подходящую затравку с центрами кристаллизации. При пересыщении выше определенной величины (предела метастабильности) раствор рассматривается как лабильный, т.е. способный к самопроизвольной кристаллизации.
Таким образом, при изучении температурной зависимости растворимости мы можем получить следующие два вида зависимостей (рис. 7.1).
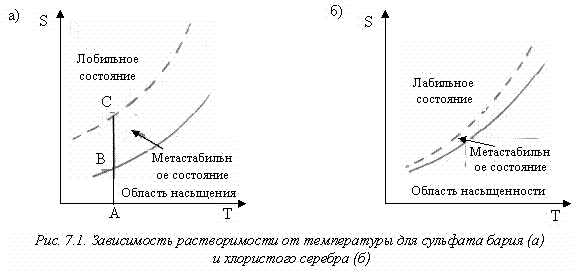 Если при температуре А (рис. 7.1, а) постепенно повышать концентрацию осаждаемого вещества, например, медленным добавлением осадителя при энергичном перемешивании или путем постепенного образования осадителя в результате гомогенной реакции, то никакого осадка до точки С не образуется. Если теперь прекратить добавление осадителя, концентрация понизится до точки В, часть вещества окажется в осадке.
Если при температуре А (рис. 7.1, а) постепенно повышать концентрацию осаждаемого вещества, например, медленным добавлением осадителя при энергичном перемешивании или путем постепенного образования осадителя в результате гомогенной реакции, то никакого осадка до точки С не образуется. Если теперь прекратить добавление осадителя, концентрация понизится до точки В, часть вещества окажется в осадке.
Дальнейшее прибавление реактива не приведет к образованию новых центров кристаллизации, если концентрация осадителя в какой-то момент не достигнет точки С. Следовательно, образующийся при атом осадок должен быть крупнозернистым и однородным по размеру частиц. Значит, для того, чтобы получить однородный осадок, необходимо концентрацию осадителя поддерживать в пределах, отвечающих области метастабильного состояния.
Эта задача трудновыполнима, поскольку область метастабильности очень узка (рис. 7.1, б). Для сульфата бария можно получить осадок, состоящий из крупных однородных кристаллов, для хлористого серебра осадок получается в виде мелких первич
ных кристалликов, сросшихся в агрегаты, так называемый творожистый осадок. Заметим, что оба осадка кристаллические, и растворимости обоих веществ примерно одинаковы.
Кроме кристаллических осадков аналитикам приходится использовать и рентгеноаморфные. Примерами таких осадков являются гидроксиды железа и алюминия. В настоящее время известно, что при осаждении гидроксида железа первичный осадок состоит из аморфных агрегатов с размерами до несколько тысяч ангстрем. Эти агрегаты состоят из мелких неокристаллизованных частиц с размерами 30 – 40 ангстрем, которые называют первичными частицами. Размеры этих частиц, как показали электронномикроскопические исследования, удивительно постоянны и почти не зависят от условий осаждения.
Механизм образования осадка сводится к следующему. При добавлении щелочи к раствору соли железа происходит замещение молекул воды на гидроксил во внутренней координационной сфере по уравнению:
![]() .
.
На промежуточных ступенях этого процесса проходят процессы полимеризации:
![]()
Полимер состоит из многих звеньев и может образовывать пространственную структуру с молекулярным весом, достигающим несколько тысяч, нерегулярного, изменяющегося состава. Из этих полимеров образуется коллоидный раствор. Ядра мицелл коллоида и являются первичными частицами с размером 30 – 40 ангстрем, из них образуется аморфный осадок, когда под действием электролита коллоидный раствор коагулирует.
В связи с использованием таких терминов, как коллоидный раствор и ядро мицеллы, нам придется познакомиться с некоторыми понятиями коллоидной химии. Кроме трех агрегатных состояний вещества (твердого, жидкого и газообразного) существует еще одно – коллоидное, которое характеризуется тем, что сравнительно крупные частицы твердой фазы диспергированы в какой-либо среде. Средой может быть жидкость или газ.
Размеры коллоидных частиц лежат в интервале 10-7 – 10-4 см, обычно в таких частицах содержится 103 – 109 атомов. Столь малые размера приводят к тому, что энергии теплового движения оказывается вполне достаточно для того, чтобы преодолеть силы тяготения, и поэтому коллоидные частицы не оседают на дно сосуда, как это наблюдается у суспензий, размер частиц которых несравненно больше.
Размеры коллоидных частиц во много раз больше размеров обычных молекул, и поэтому коллоидные растворы рассеивают свет, а молекулярные – нет. По этому признаку легко отличить коллоидные растворы от молекулярных или ионных. Коллоидные растворы, по-другому их называют золями, – это термодинамически устойчивые системы.
Рассмотрим строение коллоидной частицы (рис. 7.2), иногда ее называют мицеллой. Она имеет ядро, состоящее из твердой фазы, которая может быть как кристаллической, так и аморфной. В случае йодистого серебра это будет кристаллический АgI, а в случае гидроксида железа – аморфный Fe(OH)3.
Поскольку на поверхности твердой фазы силовое поле оказывается нескомпенсированным по сравнению с объемом, это служит причиной притяжения этой поверхностью молекул и ионов, т.е. наблюдается адсорбция на поверхности. Твердое вещество совсем необязательно должно притягивать с одинаковой силой оба своих иона. Поэтому на поверхности ядра мицеллы оказывается слой прочно адсорбированных одноименных ионов, в данном случае Аg+ – ионов, которые сообщают свой заряд всей частице.
Система в целом должна быть электронейтральной, поэтому вокруг этой частицы должно разместиться определенное число ионов противоположного знака, в данном случае NО3-. Таким образом, возникает двойной электрический слой, который и делает систему устойчивой. Итак, двойной слой состоит из слоя потенциалопределяющих ионов на поверхности твердой фазы и слоя противоположно заряженных ионов, находящихся в жидкой фазе.
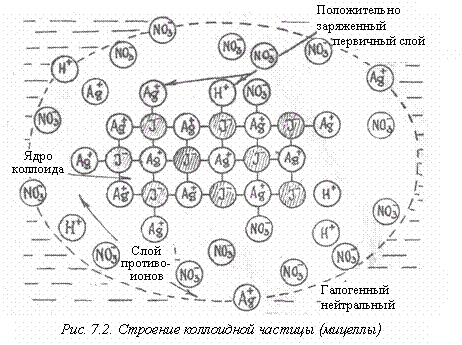 Слой противоионов имеет диффузное строение. Такая коллоидная частица участвует в тепловом движении как единое целое, а поскольку у каждой частицы на периферии оказываются противоионы одного знака, наблюдается электростатическое отталкивание коллоидных частиц.
Слой противоионов имеет диффузное строение. Такая коллоидная частица участвует в тепловом движении как единое целое, а поскольку у каждой частицы на периферии оказываются противоионы одного знака, наблюдается электростатическое отталкивание коллоидных частиц.
Для того чтобы заставить коллоидную систему коагулировать или, по-другому, вызвать флоккуляцию, т.е. слипание частиц и образование осадка, необходимо, чтобы силы притяжения между частицами были больше сил отталкивания. Силы притяжения в основном определяются силами Ван-дер-Ваальса, и на них мы воздействовать не можем. Силы же отталкивания – это электростатические силы, и здесь мы можем вполне сознательно их регулировать, вводя посторонние электролиты.
В больших концентрациях посторонний электролит может вызвать перезарядку поверхности. Если поверхность была заряжена положительно, т.е. потенциалопределявшими ионами были катионы, то теперь она будет заряжена отрицательно, поскольку потенциалопределяющими ионами стали анионы. Точка, в которой происходит перемена знака заряда, носит название изоэлектрической. В этой точке, определяемой концентрацией потенциалобразующего иона, потенциал поверхности оказывается равным нулю и, тем самым, создаются максимально благоприятные условия для флоккуляции коллоидной системы.
В принципе необязательно для флоккуляции создавать нулевой потенциал, можно так уменьшить толщину диффузного слоя противоионов, чтобы при столкновении частиц гидратные слои, содержащие противоионы, стали бы общими – отталкивание исчезнет, и коллоид коагулирует. Введение посторонних электролитов как раз и вызывает такое явление, чем и объясняется коагулирующее действие электролитов.
Весьма неприятным следствием образования коллоидных систем является пептизация осадка. Это явление заключается в том, что при промывании осадка растворите
лем он растворяется за счет образования коллоидного раствора. Образование коллоидного раствора и его флоккуляция, по-видимому, является одним из главных звеньев в ходе образования аморфного осадка.
 Механизм образования первичного аморфного осадка гидроксида выглядит следующим образом:
Механизм образования первичного аморфного осадка гидроксида выглядит следующим образом:
Образовавшийся первичный осадок, независимо от того, является он кристаллическим или аморфным, претерпевает во времени ряд превращений, которые носят общее название «старение». «Старение» включает все необратимые структурные изменения, происходящие в осадке с момента его образования.
Основными экспериментальными приемами изучения старения является изучение обмена радиоактивной метки между осадком и раствором и исследование адсорбции красителей на осадках. Интересно отметить, что скорость старения практически падает до нуля, если на поверхности кристаллов находится адсорбированный слой красителя. Из этих экспериментов следует, что первичный, осадок находится в динамическом равновесии с маточным раствором, причем скорость обмена падает во времени.
Термическое старение можно определить как процесс совершенствования частиц в результате теплового движении, а не в результате перекристаллизации. Скорость этого процесса не зависит от наличия или присутствия растворителя и его природы.
Во времена Оствальда, когда впервые было показано, что растворимость очень мелких частиц необычайно велика, по сравнению с обычной растворимостью, пришли к выводу, что свежеобразованный осадок должен подвергаться «созреванию» вследствие растворения мелких частиц и роста крупных. Повышенная растворимость мелких частиц объясняется большей поверхностной энергией их по сравнению с крупными. Это вид старения, который носит название оствальдовского созревания играет существенную роль в том случае, когда гранулометрический состав первичного осадка чрезвычайно разнообразен.
Из других видов старения следует отметить соединение первичных кристаллов в агломераты и превращение метастабильной модификации в другую, более устойчивую форму. Так, эти превращения наблюдаются при осаждении оксалата кальция, когда первоначально выпадает дигидрат – CaC2O4.2H2O и тригидрат – CaC2O4.3H2O, а в процессе старения они переходят в устойчивый моногидрат – CaC2O4.H2O.
Химическое старение, происходит в результате изменения состава. Химическое старение играет важную роль при образовании аморфных осадков. Например, при стоянии осадка гидроксида железа под слоем маточного раствора начинает протекать дегидратация, и при достижении определенной степени дегидратации полимерная структура мицелл распадается на отдельные молекулы FeООН.nН2O или Fe2О3.nН2О, из которых образуются центры кристаллизации. Заметим, что в отличие от кристаллических осадков здесь растворения и перекристаллизации первичной частицы не происходит.
Укрупнение первичных кристаллов происходит за счет прирастания первичных частиц осадка, в которых уже прошел процесс распада полимерной молекулы, но центра кристаллизации не оказалось. Осадок на этой стадии всегда состоит из некоторого количества крупных (вторичных) кристаллов и части первичных частиц. Вторичные кристаллы имеют зернистую структуру с размерами зерен 30 – 40 ангстрем, т.е. представляют собой сростки мозаичной структуры.
Механизм образования осадков интересует аналитика не сам по себе, а только в той степени, в какой эти знания обеспечивают получение осадка, удовлетворяющего целям анализа. Одним из требований к осадкам является их чистота. Различается два
класса загрязнений: соосаждение и послеосажение. При соосаждении основное вещество и примесь осаждаются вместе, тогда, как при послеосаждении, сначала выделяется чистый основной осадок, а уже потом осаждается примесь.
Следует заметить, что соосаждение заключается только в захвате примесей из ненасыщенного раствора. Послеосажение обычно происходит из пересыщенного раствора. Если одновременно из насыщенного раствора осаждается и основное вещество, и примесь, то говорят о совместном осаждении.