Горючие системы могут быть химически однородными и неоднородными. К химически однородным относятся системы, в которых горючее вещество и воздух равномерно перемешаны: смеси горючих газов, паров или пылей с воздухом. К химически
неоднородным относятся системы, в которых горючее вещество и воздух не перемешаны и имеют поверхности раздела: твердые горючие материалы и жидкости, находящиеся в воздухе, струи горючих газов и паров, поступающие в воздух и т.д.
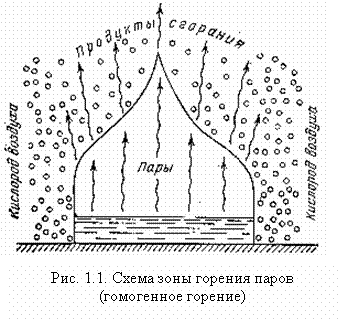
Примером горения газов и паров (гомогенное горение) является горение паров, поднимающихся со свободной поверхности жидкости (рис. 1.1) или горение газа, выходящего из трубы. Так как парциальное давление кислорода воздуха равно 21,2 кПа, а в зоне горения давление равно нулю, кислород из воздуха диффундирует через слой продуктов сгорания к зоне горения. Следовательно, скорость реакции горения зависит от скорости диффузии кислорода.
 Примером горения на поверхности твердого вещества (гетерогенное горение) является горение антрацита, кокса, древесного угля. В этом случае диффузии кислорода к зоне горения также препятствуют продукты сгорания, что видно из схемы, показанной на рис. 1.2. Концентрация кислорода в объеме воздуха (С1) значительно больше концентрации его вблизи зоны горения (С0). В отсутствие достаточного количества кислорода в зоне горения химическая реакция тормозится.
Примером горения на поверхности твердого вещества (гетерогенное горение) является горение антрацита, кокса, древесного угля. В этом случае диффузии кислорода к зоне горения также препятствуют продукты сгорания, что видно из схемы, показанной на рис. 1.2. Концентрация кислорода в объеме воздуха (С1) значительно больше концентрации его вблизи зоны горения (С0). В отсутствие достаточного количества кислорода в зоне горения химическая реакция тормозится.
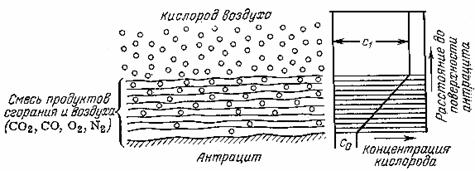
Рис. 1.2. Схема диффузии кислорода в зону горения твердого вещества
(гетерогенное горение)
Таким образом, полное время сгорания химически неоднородной горючей системы складывается из времени, необходимого для возникновения физического контакта
между горючим веществом и кислородом воздуха ![]() , и времени, затрачиваемого на протекание самой химической реакции
, и времени, затрачиваемого на протекание самой химической реакции ![]() :
:
![]() .
.
В случае гомогенного горения величина ![]() называется временем смесеобразования, а в случае гетерогенного горения – временем транспортировки кислорода из воздуха к твердой поверхности горения.
называется временем смесеобразования, а в случае гетерогенного горения – временем транспортировки кислорода из воздуха к твердой поверхности горения.
В зависимости от соотношения ![]() и
и ![]() горение называется диффузионным или кинетическим. При горении химически неоднородных горючих систем время диффузии кислорода к горючему веществу несоизмеримо больше времени, необходимого для протекания химической реакции, т.е.
горение называется диффузионным или кинетическим. При горении химически неоднородных горючих систем время диффузии кислорода к горючему веществу несоизмеримо больше времени, необходимого для протекания химической реакции, т.е. ![]() >>
>>![]() и практически
и практически ![]() . Это значит, что скорость горения определяется скоростью диффузии кислорода к горючему веществу. В этом случае говорят, что процесс протекает в диффузионной области. Такое горение и называется диффузионным. Все пожары представляют собой диффузионное горение.
. Это значит, что скорость горения определяется скоростью диффузии кислорода к горючему веществу. В этом случае говорят, что процесс протекает в диффузионной области. Такое горение и называется диффузионным. Все пожары представляют собой диффузионное горение.
Если время физической стадии процесса оказывается несоизмеримо меньше времени, необходимого для протекания химической реакции, т.е. ![]() <<
<<![]() , то можно принять
, то можно принять ![]() . Скорость процесса практически определяется только скоростью химической реакции. Такое горение называется кинетическим. Так горят химически однородные горючие системы, в которых молекулы кислорода хорошо перемешаны с молекулами горючего вещества, и не затрачивается время на смесеприготовление. Так как скорость химической реакции при высокой температуре велика, горение таких смесей происходит мгновенно и носит характер взрыва. Если продолжительность химической реакции и физическая стадия процесса горения соизмеримы, то горение протекает в так называемой промежуточной области, в которой на скорость горения влияют как химические, так и физические факторы.
. Скорость процесса практически определяется только скоростью химической реакции. Такое горение называется кинетическим. Так горят химически однородные горючие системы, в которых молекулы кислорода хорошо перемешаны с молекулами горючего вещества, и не затрачивается время на смесеприготовление. Так как скорость химической реакции при высокой температуре велика, горение таких смесей происходит мгновенно и носит характер взрыва. Если продолжительность химической реакции и физическая стадия процесса горения соизмеримы, то горение протекает в так называемой промежуточной области, в которой на скорость горения влияют как химические, так и физические факторы.
На рис. 1.3 показана зависимость скорости реакции горения от температуры в различных областях. Кривая 1 показывает изменение скорости реакции при кинетическом горении. При низких температурах скорость реакции окисления в смеси слабо зависит от изменения температуры, и кривая 1 на этом участке медленно поднимается вверх. При более высоких температурах скорость реакция окисления начинает сильно ускоряться с повышением температуры, и кривая 1 круто поднимается. Таким образом, скорость реакции в кинетической области зависит только от температуры реагирующих веществ.
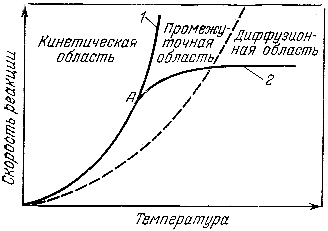
Рис. 1.3. Зависимость скорости кинетического (1) и диффузионного (2)
горения от температуры
Кривая 2 показывает изменение скорости реакции при диффузном горении. При низких температурах ход кривой 2 одинаков с кривой 1, так скорость реакции окисления меньше скорости диффузии кислорода в зону горения и, следовательно, реакция протекает в кинетической области. При повышении температуры реагирующих веществ скорость реакции становится равной скорости диффузии кислорода в зону горения, а затем значительно превышает ее. В этих условиях скорость всего процесса определяется скоростью диффузии кислорода. Кривая 2 в точке А изменяет свое направление, отклоняясь вправо от кривой 1. Дальнейший ход кривой 2 показывает, что скорость процесса горения в диффузионной области, определяемая скоростью диффузии, очень мало зависит от температуры.