Для очистки сточных вод от различных растворимых и диспергированных примесей применяют процессы анодного окисления и катодного восстановления, электрокоагуляции, электрофлотации, электродиализа и электрокаталитического окисления. Все эти процессы протекают на электродах при пропускании через сточную воду постоянного электрического тока. Электрохимические методы позволяют извлекать из сточных вод ценные продукты при относительно простой автоматизированной технологической схеме очистки, без использования химических реагентов. Основным недостатком этих методов является относительно большой расход электроэнергии. Очистку сточных вод электрохимическими методами можно проводить периодически или непрерывно.
Эффективность электрохимических методов оценивается рядом факторов: плотностью тока, напряжением, коэффициентом полезного использования напряжения, выходом по току, выходом по энергии. Плотность тока – это отношение силы тока к поверхности электрода, которое обычно выражают в амперах на метр квадратный (А/м2). Напряжение электролизера складывается из разности электродных потенциалов и падения напряжения в растворе:
и = еа – ек + Δеа + Δек + Δuэл + Δuдиаф
где Δеа и Δек – величина анодной и катодной поляризации; ел и ек – равновесные потенциалы анода и катода; Δuэл и Δидиаф – падение напряжения в электролите и диафрагме соответственно.
Падение напряжения в электролите (сточной воде) при отсутствии пузырьков газа определяется по закону Ома:
Δuэл = iρδ,
где i – плотность тока в сточной воде, А/см2; ρ – удельное сопротивление, Ом∙см; δ – расстояние между электродами, см.
При выделении газовых пузырьков вследствие удлинения потока между электродами Δuэл возрастает. Отношение
![]()
называют коэффициентом полезного использования напряжения. Выход по току – это отношение теоретически необходимого количества электричества (находится по закону Фарадея) к практически затраченному, которое выражается в долях единицы или в процентах.
Анодное окисление и катодное восстановление
В электролизере (рис. 1.23) на положительном электроде (аноде) ионы отдают электроны, т.е. протекает реакция электрохимического окисления; на отрицательном электроде (катоде) происходит присоединение электронов, т.е. протекает реакция восстановления.
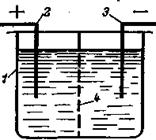
Рис. 1.23. Электролизер:
1 – корпус; 2 – анод; 3 – катод; 4 – диафрагма
Эти процессы разработаны для очистки сточных вод от растворенных примесей: цианидов, роданидов, аминов, спиртов, альдегидов, нитросоединений, азокрасителей, сульфидов, меркантанов и др. В процессах электрохимического окисления вещества, находящиеся в сточных водах, полностью распадаются с образованием СО2, NH3 и воды или образуются более простые и нетоксичные вещества, которые можно удалить другими методами.
В качестве анодов используют различные электролитические нерастворимые материалы: графит, магнетит, двуокиси свинца, марганца и рутения, которые наносятся на титановую основу. Катоды изготавливают из молибдена, сплава вольфрама с железом или никелем, из графита, нержавеющей стали и других металлов, покрытых молибденом, вольфрамом или их сплавами.
Процесс проводят в электролизерах с диафрагмой и без нее. Кроме основных процессов электроокисления и восстановления, одновременно могут протекать электрофлотация, электрофорез и электрокоагуляция.
Анодное окисление цианидов протекает по реакциям:
CN- + 2ОН- – 2е.→ CNО- + Н2О
CNО- + 2Н2О → NH4 + СО32-
Окисление может быть проведено и с образованием азота:
2CNO + 4OН- – 6е → 2СО2 + N2 + 2Н2О
Для повышения электропроводности сточных вод и снижения расхода энергии в воду добавляют NaCl. При концентрации CN 1 г/л добавляется 20…30 г/л NaCl. В этом процессе используется графитовый анод и стальной катод. Оптимальные условия окисления:
· плотность анодного тока 3…4 А/дм2;
· межэлектродное пространство 3 см;
· скорость воды 30 л/ч;
· рН = 8…9.
Степень очистки приближается к 100 %.
Разрушение цианидов происходит в результате электрохимического окисления на аноде и окисления хлором, выделяющимся на аноде в результате разложения NaCl.
Сульфид-ионы при рН = 7 окисляются до сульфатов. При меньших значениях рН может образоваться элементная сера. Окисление фенолов в присутствии хлоридов в сточной воде протекает по следующим реакциям:
4ОН- – 4е → 2Н2О + О2
2Н+ + 2е → Н2
2С1- – 2е → С12
С12 + Н2О → НСlO + НС1
НСlO + ОН- → Н2О + СlO-
12ClO- + 6H2O – 12е → 4НС1О3 + 8НС1 + 3O2
C6H5OH+14∙O → 6СО2 + 3Н2О.
Электрохимическое окисление фенолов выгодно при небольших концентрациях их в воде.
Катодное восстановление можно использовать для очистки сточных вод, содержащих трудноокисляемые органические вещества или ионы тяжелых металлов: Рb2+, Sn2+, Hg2+ Cu2+, As3+, Сr6+. Катодное восстановление металлов происходит по схеме
Men+ + n∙e- → Ме0.
При этом металлы осаждаются на катоде, и могут быть рекуперированы. Например, при восстановлении соединений хрома была достигнута высокая степень очистки: концентрация с 1 000 мг/л снижалась до 1 мг/л. Расход электроэнергии на очистку составил 0,12 (кВт∙ч)/м3. При электролизе сточных вод, содержащих H2Сr2О7, оптимальное значение рН 2, а плотность тока 0,2…2 А/дм2. Реакция, восстановления протекает следующим образом:
Сr2O72- + 14Н+ + 12е → 2Сr + 7Н2О
Очистку сточных вод от ионов Hg2+, Pb2+, Cd2+, Cu2+ проводят на катодах, состоящих из смеси угольного и сернистого порошков в соотношении С : S от 80 : 20 до 20 : 80, при рН < 7 и плотности тока 2,5 А/дм2. Осаждение этих ионов происходит в виде нерастворимых сульфидов или бисульфидов, которые удаляют механически.
При восстановлении нитрата аммония на графитовом электроде он превращается в нитрит аммония, который разлагается при нагревании до элементного азота:
NH4NО3 + 2H+ + 2е → NН4NO2 + H2O
NH4NО2 → N2 + 2H2О
Исследования показали высокую эффективность электрохимического окисления и восстановления при обесцвечивании сточных вод от различных красителей, а также
очистки сточных вод целлюлозно-бумажных, нефтеперерабатывающих, нефтехимических и других заводов.