Степень окисления органических загрязнений может быть повышена за счет дополнительного ввода в обрабатываемую воду поваренной соли, при электролизе которой образуется активный хлор, обладающий достаточно высоким окислительным потенциалом. Для деструкции трудноокисляемой органики необходимо создать избыток активного хлора, что, однако, не всегда обеспечивает требуемый эффект очистки, но вызывает необходимость дехлорирования и повышает затраты на очистку сточных вод. Снизить затраты и повысить эффективность очистки можно при использовании катализаторов восстановления активного хлора – активированных углей, гидроксидов и оксидов металлов переменной валентности. Наибольшей эффективностью обладают соединения металлов, изменяющие свою валентность в широком интервале, например марганца.
При сравнении действия смеси гидроксидов металлов Mn – Fe, Mn – Сr и Fe – Сr оказалось, что наибольшей активностью обладает смесь гидроксидов Мn – Сr. Марганец по сравнению с другими металлами обладает способностью менять свою валентность на 4 и 5 единиц (от Мn2+ до Мn7+), оставаясь устойчивым в водном растворе. Энергетические затраты при последующем окислении иона марганца мало зависят от степени его окисления, т.е. ион марганца может одновременно взаимодействовать с несколькими молекулами активного хлора. Этим можно объяснить высокую активность марганца. По аналогии с марганцем можно предположить, что ионы хрома должны быть более активными, чем ионы Со2+, Cu2+, Fe2+, Ni2+ и др. По-видимому, этим объясняется высокая активность смеси гидроксидов марганца и хрома. Вероятно также, что ионы металлов переменной валентности, встречающиеся в некоторых категориях сточных вод, катализируют процесс электрохимического окисления органических загрязнений.
Процесс электрохимической деструкции с каталитическим окислением органических примесей осуществляют двумя методами:
1) введением в электродное пространство вместе с потоком жидкости подвижного или гранулированного неподвижного катализатора;
2) введением катализатора в поток после электролиза в специальном реакторе.
Преимуществом первой схемы является возможность многократного использования хлорид-иона в том же реакторе, поскольку атомарный кислород немедленно вступает в реакцию окисления из-за своей термодинамической неустойчивости, а хлорид-ион опять разряжается на аноде и образует активный хлор. Концентрация хлорид-ионов в растворе остается почти неизменной, хотя они непрерывно участвуют в окислительно-восстановительных процессах, благодаря чему увеличивается общий выход активного хлора. При использовании подвижных катализаторов в поток жидкости обычно вводят металлы переменной валентности в
растворе легкорастворяющихся солей или гидроксидов. Таким же образом используются порошкообразные активированные угли.
Для очистки сточных вод различных категорий расход катализаторов по активному веществу достигает 40 кг/м3, поэтому если катализаторы не возвращать повторно в цикл очистки, то себестоимость обработки жидкости будет высокая. Снизить себестоимость можно созданием дополнительных узлов улавливания и регенерации катализаторов, что, в свою очередь, усложняет технологическую схему.
Размещение гранулированных катализаторов, активированных углей или материалов, содержащих оксиды металлов переменной валентности, в межэлектродном пространстве несколько упрощает технологическую схему очистки. Следует также отметить, что в межэлектродном пространстве гранулы катализатора работают как биполярные микроэлектроды, вследствие чего катализаторы разрушаются и уносятся вместе с потоком очищенной жидкости. Возможно забивание пор между гранулами и уменьшение пропускной способности электролизера.
Основным недостатком этого метода является разрушение активного слоя анодных пластин, выполненных с применением неблагородных металлов. В последнее время, как уже было сказано, для электролиза рекомендуются аноды на титановой основе с покрытиями из оксидов кобальта и марганца, магнетита и других металлов. Обычно эти покрытия слабо связаны с титановой основой, из-за чего создается значительное сопротивление переходного слоя между основой и покрытием.
При попадании в покрытие атомарный кислород, образующийся при восстановлении активного хлора, может достигать титановой основы, окислять ее и увеличивать сопротивление переходного слоя. Анод начинает нагреваться, и вследствие разницы коэффициентов температурного расширения титановой основы и оксидного покрытия происходит расслоение и разрушение активного слоя. Постепенно анод выходит из строя, поэтому введение катализатора в межэлектродное пространство по указанным причинам нежелательно.
По второму варианту катализ осуществляется в отдельном реакторе. В этом случае электролизер может служить для минерализации легкоокисляемых органических загрязнений и получения активного хлора в необходимом количестве. Катализ в отдельном реакторе можно проводить как с растворенным, так и с гранулированным катализатором. Растворенные и мелко диспергированные катализаторы также требуют улавливания и возврата. Процесс технологически проще выполняется с гранулированными катализаторами. Известны два основных варианта контакта гранулированной загрузки с потоком жидкости: в виде насыпных устройств и в виде взвешенного слоя.
Данные химической технологии свидетельствуют, что наиболее эффективным является контакт во взвешенном слое катализатора. Следует учесть, что окислительно-восстановительные реакции могут протекать по радикально-цепному механизму. Длина цепи радикально-цепных реакций в растворах кислородных соединений хлора небольшая, поэтому необходимо стремиться к уменьшению слоя обрабатываемой жидкости. Этому в определенной мере способствует неподвижный слой гранулированного катализатора, обеспечивающий высокую турбулизацию потока жидкости.
В реакторе с гранулированной загрузкой окислению подвергается оставшаяся трудноокисляемая органика и обеспечивается дехлорирование очищенной воды, поэтому оптимальное сочетание электролиза и последующего катализа может обеспечить высокую эффективность очистки при минимальных затратах электроэнергии. Такая технологическая схема является наиболее перспективной.
В гипохлоритных растворах каталитически образующийся атомарный кислород интенсивно взаимодействует с трудноокисляемыми органическими соединениями. Выделение кислорода в атмосферу уменьшается, а скорость восстановления гипохлорита при этом почти такая же, как и в отсутствие органики. В качестве катализаторов в исследованиях использованы свежеосажденная окись кобальта и хлорид кобальта.
Существуют различные трактовки механизма каталитического разложения активного хлора. С использованием гидроксидов металлов переменной валентности процесс каталитического разложения можно рассматривать по следующему механизму:
СlO- + 2Со (ОН)3 + Н2О → Cl- + 2Со (ОН)4;
4Со (ОН)4 → 4Со (ОН)3 + O2 + 2Н2О.
В присутствии катализаторов возможно образование свободных радикалов СlO●, Сl●, неустойчивость которых может вызывать цепные реакции. В образовании радикалов участвуют как хлорноватистая кислота, так и гипохлорит-ион. Так, например, образование СlO●-радикалов в растворах гипохлоритов под действием Со3+ стимулируется непрерывной реакцией:
С1О- + Со3+ → СlO● + Со2+;
НС1О- + Со3+ → СlO● + Со2+ + Н+.
Активные радикалы СlO● могут способствовать реакциям образования атомарного кислорода и ОН●-радикала:
процессу, определяющему скорость разложения гипохлорита:
2С1O- + Сo3+ + ОН- → 3Сl- + ОН● + 3/2О2; (1.13)
быстрому процессу выделения атомарного кислорода:
ОН●+ОН● → Н2О + О; (1.14)
менее вероятному процессу продолжения развития цепи в сильнощелочной среде:
ОН● + СlO- → С1O● + ОН-.
Реакции (1.13) и (1.14) могут идти параллельно, каждая из которых в конечном итоге сопровождается подкислением раствора, что в действительности и происходит.
В присутствии органических соединений подкисление растворов при каталитическом восстановлении активного хлора незначительно, а кислые растворы в некоторых случаях, наоборот, приобретают более высокое значение рН. Это объясняется тем, что в чистых растворах активного хлора в радикально-цепные реакции интенсивно вовлекаются ионы гидроксила, что приводит к подкислению. При наличии в растворах органических веществ радикалы взаимодействуют с ними, и в меньшей степени затрагиваются гидроксил-ионы, цепь быстрее прерывается и в реакцию вовлекается большое количество молекул активного хлора. Вследствие этого растворы подкисляются в меньшей степени, интенсивно восстанавливается активный хлор, и окисляются за счет образующегося атомарного кислорода органические соединения.
Электрокаталитическая очистка сточных вод является новой и еще мало исследованной, особенно в области использования недорогих и доступных катализаторов, в том числе отходов промышленности, содержащих оксиды металлов переменной валентности. Однако растущее в последнее время количество публикаций по данному вопросу, позволяющих оценить состояние исследований в этой области, дает основание для определенного оптимизма. Так, например, исследован метод электрокаталитической очистки сточных вод от красителей, поверхностно-активных и текстильно-вспомогательных веществ, при котором в качестве катализатора рекомендуется использовать гранулированный активированный пиролюзит – отход термического производства диоксида марганца.
Для реализации этого метода очистки разработан комбинированный аппарат (рис. 1.25), который имеет два блока электродов 6 с нерастворимыми анодами и камеру доочистки 4 с гранулированной каталитической загрузкой 8. Вода подается в аппарат с двух сторон через штуцеры 7, последовательно проходит по электролитическим ячейкам и переливается через верхнюю кромку катодных пластин в камеру 4. Если в процессе электролиза возможно образование над электродами слоя пены, как, например, при электрофлотации поверхностно-активных веществ, то эта пена наклонными козырьками крышки 1 вытесняется также в камеру 4. Местная приточно-вытяжная вентиляция 3, предназначенная для обеспечения взрывобезопасности, используется для интенсификации пеногашения за счет создания направленной струи воздуха над слоем пены из щелевого впускного канала 2.
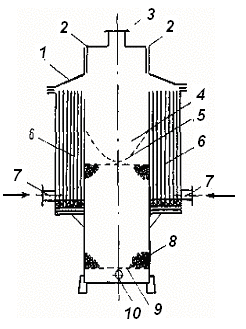
Рис. 1.25. Комбинированный аппарат для электрокаталитической очистки сточных вод:
1 – крышка; 2 – щели для поступления воздуха; 3 – патрубок для удаления газов механической вентиляцией; 4 – камера каталитического окисления сточных вод и пенного продукта; 5 – сетчатое распределительное устройство; 6 – пакеты электродов; 7 – впускные патрубки для подачи воды; 8 – гранулированная каталитическая загрузка; 9 – решетчатое поддерживающее устройство; 10 патрубок для отвода очищенных сточных вод
Струя поступающего воздуха изменяет направление движения пенного слоя, прижимает его к стенке камеры, по которой стекает очищенная вода из электродного блока. Потоки воздуха и воды, двигаясь параллельно друг другу, создают местное разрежение, что ускоряет дегазацию пены, которая быстро гасится на поверхности гранулированной загрузки. Поступающие в камеру доочистки потоки воды вместе с пеной распределяются сетчатым устройством 5 по поверхности загрузки 8.
При прохождении воды и пеноконденсата через загрузку происходит восстановление активного хлора, при котором образующийся атомарный кислород окисляет находящиеся в жидкости остаточные органические загрязнения. Очищенная вода собирается в пространстве между ложным днищем 9 и дном камеры 4 и отводится через патрубок 10.
Опытно-промышленные испытания этого аппарата производительностью 10 м3/ч при очистке сточных вод красильного цеха показали высокую его эффективность. Технико-экономические показатели аппарата следующие: площадь анодов – 16 м2, габаритные размеры – 1,4 х 1,4 х 2,3 м, нагрузка по току – 2 400 А, напряжение питания – 8 В, потребляемая мощность – 19,2 кВт.