Пространство, в котором сгорают пары и газы, называется пламенем или факелом. Пламя может быть кинетическим или диффузионным в зависимости от того, горит ли заранее подготовленная смесь паров или газов с воздухом или такая смесь образуется в пламени в процессе горения. В условиях пожара газы, жидкости и твердые вещества горят диффузионным пламенем.
Структура диффузионного пламени существенно зависит от сечения потока горючих паров и газов и скорости. По характеру потока различают ламинарное и турбулентное диффузионное пламя.
ламинарное пламя возникает при малых сечениях потока паров и газов, движущихся с небольшой скоростью (пламя свечи, спички, газа в горелке небольшого диаметра и т.п.). При пожарах образуется турбулентное пламя. Оно меньше изучено, и для объяснения этого явления используют положения теории ламинарного пламени. На рис. 1.4 показано строение ламинарного диффузионного пламени жидкости, горящей в сосуде небольшого диаметра.
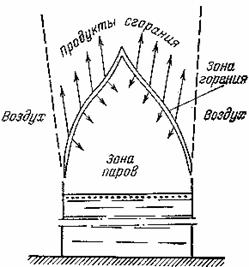
Рис. 1.4. Строение ламинарного диффузионного пламени
Пламя состоит из зоны горения и зоны паров, последняя занимает почти весь объем пламени. Подобное по строению пламя образуется также при горении газов и твердых веществ, если скорость движения газов и паров соответствует ламинарному режиму. Зона горения в диффузионном пламени представляет собой очень тонкий слой, в котором протекает реакция горения. Температура в зоне паров значительно ниже, чем в зоне горения. Так, в пламени керосина (рис. 1.5) температура потока паров около поверхности жидкости равна температуре ее кипения.
По мере движения потока к зоне горения температура паров (на рис. 1.5 – точки на вертикальной линии) повышается: сначала за счет излучения зоны горения, а затем в результате диффузии из нее нагретых продуктов сгорания. Нагрев обусловливает термическую диссоциацию паров около зоны горения; при этом образующиеся свободные атомы и радикалы совместно с продуктами сгорания поступают в зону горения.
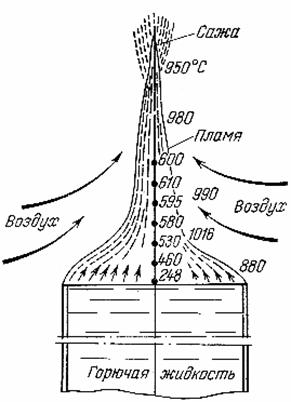
Рис. 1.5. Температура зон пламени при горении керосина
Атомы углерода, поступая в зону горения, возбуждаются, и, будучи некоторое время в свободном состоянии, светятся. Если вместо углерода вводить в пламя частицы других твердых веществ, пламя приобретает иной, чем при горении углерода, цвет. Так, если в несветящееся пламя метилового спирта ввести соль стронция, то пламя окрасится в красный цвет, при введении соли меди – в синий или зеленый цвет.
Температура зоны горения пламени меняется по высоте его. Объясняется это изменением стехиометрической смеси в зоне горения и затратой тепла на нагрев поступающего в нее воздуха. В нижней части пламени, хотя и образуется стехиометрическая смесь с наибольшей теплотой горения, однако температура горения не является здесь максимальной, так как значительное количество тепла затрачивается на нагрев холодного воздуха. В средней части пламени теплота горения стехиометрической смеси меньше, чем в нижней, что обусловлено диффузией в нее продуктов сгорания, однако поступающий в зону горения нагретый воздух компенсирует потери тепла, и температура горения в этой части пламени является максимальной. В верхней части диффузионного пламени стехиометрическая смесь имеет еще меньшую теплоту горения, и нагретый воздух, поступающий для ее образования, не может компенсировать всех потерь тепла, поэтому температура горения здесь минимальная. Поэтому в верхней части пламени часто образуется сажа.
Турбулентное пламя отличается от ламинарного тем, что не имеет четких очертаний и постоянного положения фронта пламени. Температура его при горении нефтепродуктов составляет: 1200 0С для бензина, 1110 0С для керосина тракторного, дизельного топлива, сырой нефти и 1000 0С для мазута. При горении древесины в штабелях температура турбулентного пламени составляет 1200…1300 0С.
1.3. Расход воздуха на горение
Минимальное количество воздуха, необходимого для полного сгорания единицы массы (кг) или объема (м3) горючего вещества, называется теоретически необходимым и обозначается ![]() . В табл. 1.1 приведены значения
. В табл. 1.1 приведены значения ![]() для различных веществ при нормальных условиях (0 0С и 101,3 кПа). Значения величин, приведенных для древесины, торфа, бензина, керосина, нефти, являются средними, так состав этих горючих материалов непостоянен.
для различных веществ при нормальных условиях (0 0С и 101,3 кПа). Значения величин, приведенных для древесины, торфа, бензина, керосина, нефти, являются средними, так состав этих горючих материалов непостоянен.
Таблица 1.1
Теоретически необходимое количество воздуха для полного сгорания веществ
|
Горючее вещество |
Количество воздуха для полного сгорания 1 кг вещества |
Горючее вещество |
Количество воздуха для полного сгорания 1 кг вещества |
||
|
кг |
м3 |
кг |
м3 |
||
|
Ацетон |
9,45 |
7,35 |
Ацетилен |
15,40 |
11,93 |
|
Бензин |
14,3 |
11,10 |
Бутан |
39,80 |
30,94 |
|
Бензол |
13,2 |
10,25 |
Водород |
3,08 |
2,38 |
|
Древесина (W = 7 %) |
5,4 |
4,18 |
Метан |
12,30 |
9,52 |
|
Керосин |
14,85 |
11,50 |
Оксид углерода |
3,08 |
2,38 |
|
Нефть |
13,9 |
10,80 |
Пропан |
30,60 |
23,80 |
|
Толуол |
12,9 |
10,00 |
Природный газ |
6,45 |
5,00 |
|
Торф |
7,5 |
5,80 |
|||
Горючее вещество – индивидуальное химическое соединение. Для таких горючих веществ независимо от их агрегатного состояния теоретически необходимое количество воздуха определяется из уравнений реакций горения. На m кмоль горючего вещества приходится n кмоль кислорода и азота. Обозначив массу (в кг) горючего вещества, численно равную молекулярной массе его, через М, составляют пропорцию:
![]()
1 кг — ![]() , м3,
, м3,
где 22,4 – объем 1 кмоль газов (при 0 0С и 101,3 кПа).
Теоретически необходимый объем воздуха для сгорания 1 кг вещества равен (из пропорции):
![]() . (1.1)
. (1.1)
Если объем воздуха, полученный по формуле (1.1), необходимо привести к иным условиям, то пользуются формулой
![]() , (1.2),
, (1.2),
где Т – заданная температура газов; К, Р – заданное давление, Па.
Теоретически необходимый объем воздуха для сгорания 1 м3 горючих газов определяется по формуле
![]() . (1.3)
. (1.3)
Пример 1.1. Определить объем воздуха, необходимый для сгорания 1 кг бензола при 20 0С и давлении 99992 Па.
Составляем уравнение реакции горения бензола в воздухе
С6Н6 + 7,5О2 + 7,5 × 3,76N2 = 6СО2 + 3Н2О + 28,2 N2.
Согласно уравнению реакции, на горение 1 кмоля бензола требуется n = 7,5 + 7,5 × ×3,76 = 35,7 кмоля воздуха.
Молекулярная масса бензола 78.
По уравнению (1.1) определяем теоретически необходимый объем воздуха для сгорания 1 кмоля бензола при нормальных условиях
![]() .
.
При заданных условиях этот объем будет равен [уравнение (1.2) ]
![]() .
.
Горючее вещество – сложная смесь химических соединений. Такими веществами являются древесина, торф, каменный уголь и др.
Для определения теоретически необходимого объема воздуха нужно знать элементный состав горючего вещества, выраженный в массовых процентах, т.е. содержание С, Н, О, S, N, золы (А), влаги (W). Элементный состав вещества определяется в аналитической лаборатории. Чтобы рассчитать ![]() , запишем уравнение реакции горения углерода, водорода и серы и массовое соотношение реагирующих веществ:
, запишем уравнение реакции горения углерода, водорода и серы и массовое соотношение реагирующих веществ:
С + О2 = СО2 2Н + О2 = 2Н2О S + O2 = SO2
12 + 32 = 44 4 + 32 = 36 32 + 32 = 64
Если для сгорания 12 кг углерода требуется 32 кг кислорода, то для 0,01 кг углерода, т.е. 1 % (масс.) его потребуется кислорода ![]() кг, для водорода соответственно потребуется
кг, для водорода соответственно потребуется ![]() кг, для серы
кг, для серы ![]() 1 кг кислорода.
1 кг кислорода.
Для полного сгорания 1 кг горючего вещества потребуется кислорода (в кг):
![]() ,
,
где ![]() ,
, ![]() ,
,![]() ,
,![]() — содержание углерода, водорода, серы и кислорода в горючем веществе, % (масс.).
— содержание углерода, водорода, серы и кислорода в горючем веществе, % (масс.).
На вычисленное количества кислорода в воздухе приходится в 77/23 раза больше азота. Сумма азота и кислорода составляет массу воздуха ![]() (кг), необходимую для горения 1 кг вещества.
(кг), необходимую для горения 1 кг вещества.
![]() .
.
После преобразования получим:
![]() . (1.4)
. (1.4)
Чтобы выразить количество воздуха в объемных единицах, нужно правую часть выражения (1.4) разделить на массу 1 м3 воздуха при нормальных условиях, т.е. на 1,293 кг/м3. В результате получим
![]() . (1.5)
. (1.5)
Горючее вещество – смесь газов. К этой группе веществ относятся горючие газы, например природный, доменный, коксовый и др. Все они в том или ином качестве содержат СО, СН4, Н2, Н2S, С2Н4 и др. Состав горючих газов обычно выражают в объемных процентах. Для вывода формулы расчета ![]() напишем уравнение реакции горения наиболее распространенных газов:
напишем уравнение реакции горения наиболее распространенных газов:
СН4 + 2О2 = СО2 + 2Н2О Н2S + 1,5O2 = Н2О + SO2
2СО + О2= 2СО2 2Н2 + O2 = 2Н2О
Если для сгорания 1 м3 метана требуется 2 м3 кислорода, как это видно из уравнения, то для сгорания 0,01 м3 метана, т.е. 1 % (об.), потребуется ![]() кислорода. Для сгорания 1 м3 оксида углерода потребуется 0,01/2 м3 кислорода, такое же количество кислорода потребуется для сгорания 1 м3 водорода, а для сгорания сероводорода необходимо 0,01×1,5 м3 кислорода.
кислорода. Для сгорания 1 м3 оксида углерода потребуется 0,01/2 м3 кислорода, такое же количество кислорода потребуется для сгорания 1 м3 водорода, а для сгорания сероводорода необходимо 0,01×1,5 м3 кислорода.
Для полного сгорания 1 м3 горючего газа потребуется кислорода (м3):
![]() ,
,
где ![]() ,
, ![]() ,
, ![]() ,
, ![]() и
и ![]() — содержание метана, водорода, оксида углерода, сероводорода и кислорода, % (об.).
— содержание метана, водорода, оксида углерода, сероводорода и кислорода, % (об.).
В воздухе на этот объем кислорода приходится в 79/21 раза больше азота. Сумма азота и кислорода составляет объем (м3) воздуха, необходимый для сгорания 1 м3 газа.
![]() .
.
После преобразования получим:
![]() . (1.6)
. (1.6)
Как видно из уравнения (1.6), числа в его числителе есть коэффициенты при кислороде в уравнениях реакции горения. Поэтому если в составе газа будут другие горючие компоненты, они могут быть поставлены в уравнение (1.6) с коэффициентами, взятыми из их уравнений горения.
Практически при горении во время пожара расходуется воздуха значительно больше теоретически необходимого. Разность между количеством воздуха, практически расходуемым на горение, и теоретически необходимым, называется избытком воздуха. Отношение же количества воздуха, практически расходуемого на горение ![]() , к теоретически необходимому называется коэффициентом избытка воздуха и обозначается
, к теоретически необходимому называется коэффициентом избытка воздуха и обозначается
![]() . (1.7)
. (1.7)
Таким образом, в условиях пожара, когда горение протекает с естественным притоком воздуха, коэффициент избытка воздуха в большинстве случаев больше единицы и колеблется в широких пределах (2…20 и выше). коэффициент избытка воздуха можно определить по составу продуктов сгорания, если произвести их газовый анализ. Учитывая, что концентрация кислорода в воздухе составляет 21 % (об.), а процентное содержание свободного кислорода в продуктах сгорания определится из анализа, можно легко найти коэффициент избытка воздуха:
![]() . (1.8)
. (1.8)
Для того чтобы запомнить изученный материал, решите задачи.
Задача 1.1. Определить объем воздуха, необходимый для сгорания 4 м3 ацетилена (С2Н2).
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
Ответ: ![]() = 47,6 м3.
= 47,6 м3.
Задача 1.2. Определить объем воздуха, необходимый для сгорания 5 кг торфа, состоящего из 40 % С, 4,0 % Н, 13 % О и 20,0 % N; А = 10 %, W = 13 %.
Азот, золу и влагу горючего вещества при определении количества воздуха ![]() не учитывать, так как они не принимают участия в реакции. Объем воздуха, необходимый для сгорания 1 кг торфа, определить по формуле (1.5).
не учитывать, так как они не принимают участия в реакции. Объем воздуха, необходимый для сгорания 1 кг торфа, определить по формуле (1.5).
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
______________________________________________________________________
Ответ: ![]() = 21,5 м3.
= 21,5 м3.