Основное количество конструкционных материалов получается в процессе кристаллизации из жидкого состояния. В зависимости от температуры любое вещество (система) может быть в твердом, жидком или в газообразном состоянии. В физической химии системой называют совокупность индивидуальных веществ (химических элементов, независимых химических соединений), между которыми или частями которых обеспечена возможность обмена энергией, а также процессов диффузии.
Вещества, которые образуют систему, называются компонентами системы. Компоненты в системе присутствуют в разных фазах.
Фазой называется однородная часть системы, отграниченная от другой части системы поверхностью раздела, при переходе через которую свойства изменяются скачком.
При переходе из жидкого состояния в твердое образуется кристаллическая решетка, возникают кристаллы. Такой процесс называется кристаллизацией.
В природе все самопроизвольно протекающие превращения, а следовательно, кристаллизация и плавление обусловлены тем, что новое состояние в новых условиях является энергетически более устойчивым, обладает меньшим запасом энергии.
Для начала кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением свободной энергии системы. Температура, при которой практически начинается кристаллизация, может быть названа фактической температурой кристаллизации. Эта температура обычно ниже теоретической (равновесной) температуры кристаллизации.
Охлаждение жидкости ниже равновесной температуры кристаллизации называется переохлаждением.
Величиной или степенью переохлаждения называют разность между теоретической и фактической температурами кристаллизации.
Если, например, теоретическая температура кристаллизации сурьмы равна 631°С, а до начала процесса кристаллизации жидкая сурьма была переохлаждена до 590°С и при этой температуре закристаллизовалась, то степень переохлаждения (п) определяется разностью:
631 – 590 = 41°С.
Процесс перехода металла из жидкого состояния в кристаллическое можно изобразить кривыми в координатах время – температура (рис. 2.1). Охлаждение металла в жидком состоянии сопровождается плавным понижением температуры и может быть названо простым охлаждением, так как при этом нет качественного изменения состояния. При достижении температуры кристаллизации на кривой температура – время появляется горизонтальная площадка (рис. 2.1, кривая 1), так как отвод тепла компенсируется выделяющейся при кристаллизации скрытой теплотой кристаллизации. По окончании кристаллизации, т.е. после полного перехода в твердое состояние, температура снова начинает снижаться, и твердое кристаллическое вещество охлаждается. Теоретически процесс кристаллизации изображается кривой 1.
Кривая 2 показывает реальный процесс кристаллизации. Жидкость непрерывно охлаждается до температуры переохлаждения Тп, лежащей ниже теоретической температуры кристаллизации Тs. При охлаждении ниже температуры Тs создаются энергетические условия, необходимые для протекания процесса кристаллизации.
У некоторых металлов из-за большого переохлаждения скрытая теплота плавления выделяется в первый момент кристаллизации настолько бурно, что температура скачкообразно повышается, приближается к теоретической (рис. 2.1, кривая 3) Так кристаллизуется, например, сурьма.
Чем больше скорость охлаждения, тем больше величина переохлаждения. Для того чтобы полностью переохладить металл в жидком состоянии, требуются большие скорости охлаждения (миллионы и даже миллиарды градусов в секунду), охлаждение жидкого металла до комнатной температуры следует проводить так, чтобы получить переохлажденный жидкий металл (т.е. металл, не имеющий кристаллического строения) за ничтожную долю секунды. Такой металл называется аморфным или металлическим стеклом.
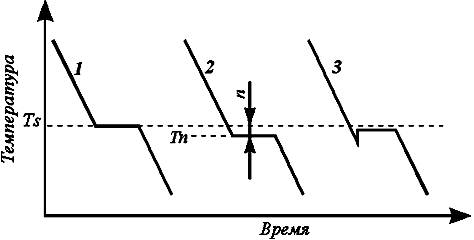
Рис. 2.1. Кривые охлаждения при кристаллизации
Еще в 1878 г. Д.К. Чернов, изучая структуру литой стали, указал, что процесс кристаллизации состоит из двух элементарных процессов. Первый процесс заключается в зарождении мельчайших частиц кристаллов, которые Чернов называл «зачатками», а теперь их называют зародышами, или центрами кристаллизации. Второй процесс состоит в росте кристаллов из этих центров (рис 2.2).
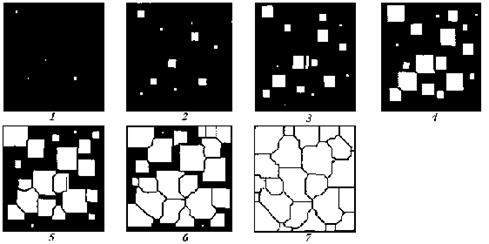
Рис. 2.2. Модель процесса кристаллизации по секундам
Рассмотрение подобных схем кристаллизации позволяет объяснить два важных момента:
1) по мере развития процесса кристаллизации в нем участвует все большее и большее число кристаллов. Поэтому процесс вначале ускоряется, пока в какой-то момент взаимное столкновение растущих кристаллов начинает заметно препятствовать их росту. Рост кристаллов замедляется еще и потому, что количество жидкости, в которой образуются новые кристаллы, становится все меньше;
2) в процессе кристаллизации, пока кристалл окружен жидкостью, он часто имеет правильную форму, но при столкновении и срастании кристаллов их правильная форма нарушается. Внешняя форма кристалла оказывается зависимой от условий соприкосновения растущих кристаллов. Вот почему кристаллы металла, зерна (кристаллиты) не имеют правильной формы.
Не только в жидких расплавах, но и при превращении в твердом состоянии новая форма также образуется путем зарождения и роста кристаллов; скорость этих процессов зависит от переохлаждения.
В отличие от кристаллизации из жидкости процесс превращения в твердом состоянии (перекристаллизация) обычно протекает при сильном переохлаждении.
Реально протекающий процесс кристаллизации усложняется действием различных факторов, в столь сильной степени влияющих на процесс, что роль степени переохлаждения может стать в количественном отношении второстепенной.
При кристаллизации из жидкого состояния для скорости течения процесса и для формы образующихся кристаллов первостепенное значение приобретают такие факторы, как скорость и направление отвода тепла, наличие нерастворившихся частиц (которые могут служить готовыми центрами кристаллизации), конвекционных токов жидкости. В направлении отвода тепла кристалл растет быстрее, чем в другом направлении.
Атомы любого элемента могут образовать, если исходить только из геометрических соображений, любую кристаллическую решетку. Однако устойчивой, а следовательно реально существующей, является решетка, обладающая наиболее низким запасом свободной энергии.
В ряде случаев при изменении температуры или давления может оказаться, что для того же металла более устойчивой будет другая решетка, не та, которая была при другой температуре или давлении. Так, например, существует железо с решетками объемно-центрированного и гранецентрированного кубов; обнаружен кобальт с гранецентрированной и с гексагональной решетками.
Существование одного металла (вещества) в нескольких кристаллических формах носит название полиморфизма, или аллотропии. Различные кристаллические формы одного вещества называются полиморфными, или аллотропическими модификациями.
Аллотропические формы обозначаются греческими буквами ![]() ,
, ![]() ,
, ![]() и т.д., которые в виде индексов добавляют к символу, обозначающему элемент. Аллотропическая форма, существующая при самой низкой температуре, обозначается буквой
и т.д., которые в виде индексов добавляют к символу, обозначающему элемент. Аллотропическая форма, существующая при самой низкой температуре, обозначается буквой ![]() , следующая –
, следующая – ![]() и т.д.
и т.д.