Химической кинетикой называется учение о скоростях химических реакций. Скорость химической реакции зависит от условий, в которых она протекает, от природы реагирующих веществ и их агрегатного состояния. Взаимодействие веществ в паровой и газовой фазах протекает быстрее, чем в жидком и твердом состоянии. Так, жидкий бензин сгорает относительно медленно коптящим пламенем (неполное сгорание), а смесь паров бензина с воздухом сгорает со взрывом. Скорость взаимодействия с участием твердых веществ сильно зависит от степени измельченности твердого вещества. Например, уголь и другие твердые горючие вещества в пылевидном состоянии образуют с воздухом взрывчатые смеси, в то время как эти же вещества при обычных условиях (не в пылеобразном состоянии) сгорают довольно медленно.
К условиям, влияющим на скорость химической реакции, относятся концентрация реагирующих веществ, температура и наличие катализаторов.
Влияние концентрации. Скорость химической реакции измеряется изменением концентрации веществ в единицу времени. Чтобы молекулы двух веществ А и В могли вступить в реакцию, они должны столкнуться. Чем выше концентрация реагирующих веществ, тем больше молекул находится в единице объема, тем больше вероятность соударения молекул. Таким образом, повышение концентрации реагирующих веществ приводит к повышению скорости химической реакции. Количественно зависимость скорости химической реакции от концентрации реагирующих веществ определяется законом действия масс[1].
В наиболее простом случае, когда молекулы двух реагирующих веществ взаимодействуют друг с другом в соотношении 1:1, согласно этому закону
![]() ,
,
где k – коэффициент пропорциональности, константа скорости реакции;![]() и
и ![]() — концентрация веществ А и В.
— концентрация веществ А и В.
В общем виде скорость реакции mA + nB = yAB выразится формулой
![]() . (2.1)
. (2.1)
Сумма показателей степеней (m+n) называется порядком реакции.
Пример 2.1. Как изменится скорость реакции 2Н2+О2=2Н2О, протекающей в закрытом сосуде, если давление увеличить в 4 раза? Обозначим концентрацию Н2 при начальном давлении через С1, а концентрацию О2 через С2, скорость реакции v1 будет равна ![]() . Если давление увеличивается в 4 раза, то во столько же раз увеличатся концентрации реагирующих веществ.
. Если давление увеличивается в 4 раза, то во столько же раз увеличатся концентрации реагирующих веществ.
![]() ,
, ![]() .
.
Скорость реакции в новых условиях будет равна
![]() .
.
Скорость реакции возрастет в 64 раза.
[1] Закон действия масс был открыт в 1867 г. норвежскими учеными Гульдбергом и Вааге.
Влияние температуры. Скорость большинства химических реакций с повышением температуры увеличивается.
Согласно правилу Вант-Гоффа (1884 г.), при повышении температуры на каждые 10 0С скорость реакции увеличивается приблизительно в 2 – 4 раза.
Почему нагревание вызывает такое значительное ускорение химического процесса? Скорость реакции пропорциональна частоте столкновений. На первый взгляд увеличение скорости можно объяснить увеличением частоты соударений реагирующих частиц. Согласно кинетической теории газов, число столкновений за единицу времени возрастает пропорционально квадратному корню из абсолютной температуры ![]() . Следовательно, при нагревании реакционной смеси от 0 до 100 0С число столкновений молекул должно возрасти всего в
. Следовательно, при нагревании реакционной смеси от 0 до 100 0С число столкновений молекул должно возрасти всего в ![]() =1,2 раза. Однако опыт показывает, что скорость реакции при нагревании системы на 100 0С возрастает в 60 000 раз.
=1,2 раза. Однако опыт показывает, что скорость реакции при нагревании системы на 100 0С возрастает в 60 000 раз.
Таким образом, объяснить увеличение скорости только увеличением числа столкновений нельзя.
Если бы необходимым условием протекания реакций было лишь соударение частиц, то нельзя было бы объяснить различие в скоростях процессов при одинаковых концентрациях реагентов; было бы непонятным действие катализатора и его специфичность. Если бы каждое столкновение оканчивалось актом взаимодействия, то все реакции протекали бы со скоростью взрыва; молекулы, содержащиеся в 1 см3 газа, испытывают такое колоссальное число соударений, что ему отвечали бы скорости, превышающие экспериментальные в сотни миллиардов раз.
Основываясь на огромном разрыве между числом реагирующих молекул (их называют активными молекулами) и общим числом столкновений, а также характере изменения скорости реакций от температуры, шведский ученый Аррениус (1889 г.) предложил уравнение, показывающее зависимость константы скорости реакции от темпера-туры
![]() ,
,
где А – фактор частоты; е – основание натуральных логарифмов; Е – энергия активации; R – универсальная газовая постоянная; Т – температура, К.
Причина увеличения скорости химической реакции с повышением температуры заключается в том, что при этом увеличивается число эффективных соударений. Известно, что те молекулы при столкновении вступают во взаимодействие, которые обладают избыточной энергией по сравнению со средней энергией молекулы. Такие молекулы называют активными, а энергию, необходимую для перевода в это состояние, называют энергией активации. Если молекулы не обладают необходимым избытком энергии, их столкновение не приводит к реакции. Например, молекулы кислорода могут сталкиваться при комнатной температуре с молекулами бензола или спирта, но реакция между ними при этом не начинается, так как сталкивающиеся частицы не обладают достаточной энергией. Если же нагреть указанные вещества до определенной температуры, т.е. сообщить им избыток энергии, то произойдет воспламенение. Молекулы активизируются чаще всего за счет тепла, но в некоторых случаях это может происходить и за счет химической энергии веществ, вступающих в реакцию с кислородом.
Влияние катализаторов. Роль катализаторов в химии исключительно велика. Многие важнейшие химические производственные процессы основаны на применении катализаторов, в частности синтез высокомолекулярных соединений, являющийся ос
новой производства пластических масс. Большую роль катализаторы играют при воспламенении и горении веществ. Влияние посторонних веществ на скорость химической реакции было замечено в начале ХIХ века. Впервые его наблюдал русский ученый К.С. Кирхгоф, установивший в 1811 г., что серная кислота ускоряет процесс превращения крахмала в сахар. Большое значение имело открытие В. Деберейнера, установившего в 1823 г., что при направлении струи водорода на губчатую платину, представляющую собой мелкораздробленный металл, водород загорается, и что для его воспламенения не требуется никакого подвода энергии. В 1835 г. И.Я. Берцелиус предложил для веществ, активизирующих процесс, название катализаторы (katalio – развязываю).
Катализаторы – вещества, которые могут активизировать реакцию или изменять ее скорость, но не могут изменить саму реакцию, ее направление, иначе говоря, катализаторы изменяют (понижают положительный катализ или повышают отрицательный) энергию активации процесса. Видимого участия в реакции катализаторы не принимают и остаются неизменными и качественно, и количественно. Катализаторы, замедляющие процесс (т.е. повышающие его энергию активации), называются ингибиторами.
Различают два вида катализа: гомогенный и гетерогенный. При гомогенном катализе катализатор и то вещество, которое участвует в реакции, образуют гомогенную смесь. Ускоряющее влияние катализаторов при гомогенном катализе объясняется теорией промежуточных реакций, иначе – образованием промежуточного комплекса. Так, реакция между веществами А и В протекает по схеме
А + В = АВ.
При добавлении катализатора К реакция пойдет с образованием промежуточного комплекса по схеме
А + К = ![]() ,
,
который взаимодействует с веществом В; при этом образуется вещество АВ и катализатор в свободном виде
![]() .
.
Такой комплекс обычно нельзя выделить в свободном виде, так как процесс с его участием (образование и взаимодействие со следующим компонентом реакции) идет мгновенно. Количество применяемого катализатора не является стехиометрическим; для ускорения процесса часто достаточно лишь его следов.
При гетерогенном катализе агрегатное состояние катализатора отличается от состояния реагирующих веществ. Например, для ускоренного разложения Н2О2 (жидкость) в качестве катализатора применяют МnО2 (твердое вещество).
Основную роль в гетерогенном катализе, особенно если катализатор находится в твердой фазе, а реагирующие вещества – в растворенном или газообразном состоянии, играет адсорбция, т.е. поглощение молекул реагирующих веществ поверхностью катализатора.
Для увеличения поверхности катализаторы обрабатывают специальными методами: измельчают, наносят на пористый материал, готовят в виде смеси с каким-либо компонентом, который затем растворяют, получая при этом катализатор в виде губчатой массы, и т.п. В качестве пористых материалов используют активный уголь, асбест, пемзу и т.п.
Отрицательные катализаторы – ингибиторы, замедляющие течение реакции, также имеют важное значение. Их применяют для предотвращения коррозии металлов, самовозгорания некоторых веществ, детонации топлива в двигателях внутреннего сгора
ния и др. Ингибиторы находят большое применение как средства пожаротушения и подавления взрывов парогазовоздушных смесей. Наиболее эффективными ингибиторами и перспективными огнетушащими средствами являются тетрафтордибромэтан (фреон 114 В2) и трифторбромметан (фреон 3В1).
2.2. Превращение горючих веществ при нагревании
Горючие вещества могут различаться по составу, агрегатному состоянию и другим свойствам. Однако воспламенение и самовоспламенение их происходят аналогично. На рис. 2.1 показана последовательность процессов, предшествующих самовоспламенению горючих веществ и заканчивающихся горением последних.
Твердые горючие вещества в зависимости от состава и строения ведут себя при нагревании по-разному. Например, сера, стеарин, каучук плавятся и испаряются. Такие вещества, как древесина, торф, каменный уголь, бумага при нагревании разлагаются с образованием газообразных продуктов и твердого остатка – угля. Некоторые горючие вещества при нагревании не плавятся и не разлагаются. К ним относятся кокс, антрацит, древесный уголь. Жидкие горючие вещества при нагревании испаряются.
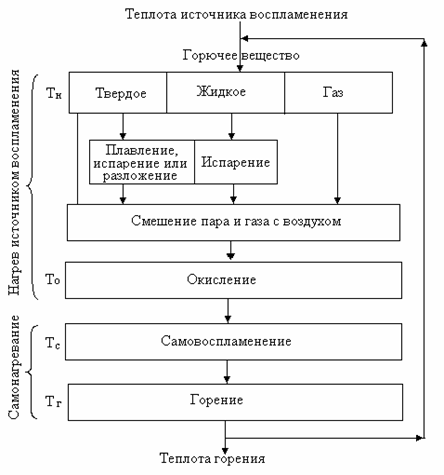
Рис. 2.1. Схема процессов, протекающих при горении
Таким образом, большинство горючих веществ независимо от их начального агрегатного состояния при нагревании переходят в газообразные продукты. С воздухом они образуют горючие смеси, подготовленные к горению. Нагрев смеси горючего с воздухом приводит к тому, что при определенной температуре Т0 начинается процесс окисления. Окисление горючих веществ сопровождается выделением тепла, которое при невысокой температуре и, следовательно, малой скорости реакции рассеивается в окружающую среду, поэтому самонагревания смеси не происходит. Только при более высокой температуре смеси и значительной скорости окисления не всё выделяющееся те
пло успевает отводиться в окружающую среду, и начинается самонагревание горючей смеси. В результате самонагревания смесь без внешнего источника тепла нагревается до температуры горения Тг, появляется пламя и возникает устойчивый процесс горения, который может продолжаться до полного выгорания вещества.
Точно так же возникает процесс горения твердых веществ, при нагревании которых не образуется смесь горючих паров или газов с воздухом. В этом случае реакция окисления протекает на поверхности горючего материала, где и возникает горение.
Теплота, выделяющаяся при горении, в основном расходуется на нагревание продуктов сгорания, некоторая же часть ее передается горючему веществу на подготовку его к горению, а часть рассеивается в окружающем пространстве.