Еще в 1878 г. Д. К. Чернов, изучая структуру литой стали, указал, что процесс кристаллизации состоит из двух элементарных процессов. Первый процесс заключается в зарождении мельчайших частиц кристаллов, которые Чернов называл «зачатками», а теперь их называют зародышами, или центрами кристаллизации. Второй процесс состоит в росте кристаллов из этих центров.
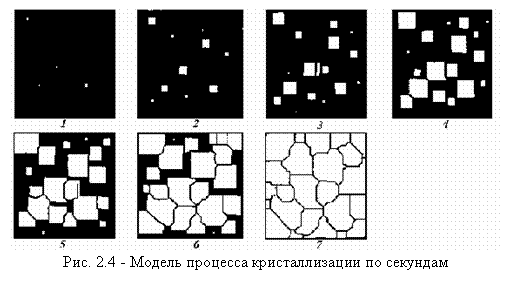
Процесс образования кристаллов путем зарождения центров кристаллизации и их роста можно изучать с помощью рассмотрения моделей (схем) кристаллизации (рис. 2.4). Предположим, что на площади 1 за секунду возникает пять зародышей, которые растут с определенной скоростью. К концу первой секунды образовалось пять зародышей, к концу второй секунды они выросли, и одновременно с этим возникло еще
пять новых зародышей будущих кристаллов. Так, в результате возникновения зародышей и их роста происходит процесс кристаллизации, который, как видно в данном примере, заканчивается на седьмой секунде.
 Рассмотрение подобных схем кристаллизации позволяет объяснить два важных момента:
Рассмотрение подобных схем кристаллизации позволяет объяснить два важных момента:
1) по мере развития процесса кристаллизации в нем участвует все большее и большее число кристаллов. Поэтому процесс вначале ускоряется, пока в какой-то момент взаимное столкновение растущих кристаллов начинает заметно препятствовать их росту. Рост кристаллов замедляется еще и потому, что количество жидкости, в которой образуются новые кристаллы, становится все меньше;
2) в процессе кристаллизации, пока кристалл окружен жидкостью, он часто имеет правильную форму, но при столкновении и срастании кристаллов их правильная форма нарушается. Внешняя форма кристалла оказывается зависимой от условий соприкосновения растущих кристаллов. Вот почему кристаллы металла, зерна (кристаллиты) не имеют правильной формы.
Скорость всего процесса кристаллизации количественно определяется двумя величинами: скоростью зарождения центров кристаллизации и скоростью роста кристаллов. Обе эти величины можно измерить для разных условий кристаллизации.
Число зарождающихся в единицу времени кристаллов, которые в дальнейшем мы будем обозначать буквами ЧЦ, имеет размерность 1/(мм3.с) (число центров кристаллизации, возникших в 1 мм3 за одну секунду). Скорость роста кристаллов обозначаемая в дальнейшем через СК, есть скорость увеличения линейных размеров кристалла, выраженная в миллиметрах в единицу времени (мм/с; мм/мин).
Исследуя кристаллизацию прозрачных органических веществ при разных температурах, Г. Тамман установил, что ЧЦ и СК определяются степенью переохлаждения. Зависимость ЧЦ и СК от переохлаждения выражается кривой с максимумом. При теоретической температуре кристаллизации (?Т = 0) значения СК и ЧЦ равны нулю, и процесс кристаллизации идти не может, что находится в полном соответствии с положением о необходимости переохлаждения для протекания процесса. С увеличением переохлаждения значения СК и ЧЦ возрастают, достигают максимума и затем понижаются, при больших величинах переохлаждения практически падают до нуля.
Увеличение СК и ЧЦ при малых степенях переохлаждения обусловлено тем, что вблизи равновесной точки (Тs) подвижность атомов велика, и ускорение кристаллизации с увеличением степени переохлаждения вызывается увеличением разности свободных энергий жидкого и кристаллического состояний. Снижение СК и ЧЦ при больших степенях переохлаждения вызвано тем, что при больших переохлаждениях и, следова
тельно, при низких температурах подвижность атомов уменьшена, а, тем самым, уменьшена и способность системы к превращению.
При больших степенях переохлаждения СК и ЧЦ становятся равными нулю, так как подвижность атомов уже недостаточна для того, чтобы осуществилась перестройка их из хаотического расположения в жидкости в правильное в кристалле.
Размер образовавшихся кристаллов зависит от соотношения величин СК и ЧЦ при температуре кристаллизации, при данной степени переохлаждения. При большом значении СК и малом значении ЧЦ, образуются немногочисленные крупные кристаллы. При малых значениях СК и больших ЧЦ (большое переохлаждение) образуется большое число мелких кристаллов.
В соответствии с кривыми Таммана, если удается очень сильно переохладить жидкость без кристаллизации, то СК и ЧЦ становятся равными нулю, жидкость сохраняется непревращенной, незакристаллизовавшейся. Соли, силикаты, органические вещества весьма склонны к переохлаждению. Для металлов же требуется переохладить жидкость до температуры, когда подвижность атомов станет мала и такое состояние окажется достаточно устойчивым.
Обычное прозрачное «твердое» стекло представляет собой переохлажденную загустевшую жидкость. Такое состояние, как мы уже говорили, является аморфным и характеризуется отсутствием определенной температуры плавления и отсутствием правильного расположения атомов в виде определенной кристаллической решетки.
Не только в жидких расплавах, но и при превращении в твердом состоянии новая форма также образуется путем зарождения и роста кристаллов; скорость этих процессов зависит от переохлаждения. В отличие от кристаллизации из жидкости процесс превращения в твердом состоянии (перекристаллизация) обычно протекает при сильном переохлаждении, и таммановская зависимость СК и ЧЦ для этого случая даже более приемлема, чем для случая первичной кристаллизации из жидкого состояния.