Молекулярный кислород при обычной температуре (температура окружающей среды 10 — 50 0С) почти не реакционноспособен. Однако существуют вещества, способные вступать в реакцию с ним в этих условиях. Механизм окисления горючих веществ молекулярным кислородом был объяснен в 1897 г. одновременно и независимо академиками А.Н. Бахом и К. Энглером. В дальнейшем академик Н.Н. Семенов с сотрудниками развил и дополнил теорию окисления и создал стройное учение о цепных реакциях. Теория цепных реакций получила мировое признание, и ее создателю академику Н.Н. Семенову в 1956 г. была присуждена Нобелевская премия.
Предложенная А.Н. Бахом и К. Энглером теория окисления была названа перекисной, так как согласно этой теории первыми продуктами окисления являются пероксиды и гидропероксиды. Органические пероксиды обычно рассматривают как производные пероксида водорода Н–О–О–Н, в котором один или два атома водорода замещены органическими радикалами R–О–О–R. Если в пероксиде водорода один атом водорода замещен радикалом, такие оксидные соединения называют гидропероксидами R–О–О–Н. Ниже приведены формулы некоторых простейших гидропероксидов и пероксидов:
Гидропероксид метила СН4О2(СН3-О-О-Н)
Гидропероксид этила С2Н6О2(С2Н5-О-О-Н)
Диметилпероксид С2Н6О2(СН3-О-О-СН3)
Диэтилпероксид С4Н10О2(С2Н5-О-О-С2Н5).
Согласно перекисной теории окисления, активация кислорода происходит в результате разрыва одной связи между атомами в молекуле кислорода, на что требуется меньше энергии (343,6 кДж/моль), чем на полную диссоциацию молекулы кислорода (488,3 кДж/моль).
О2 ![]() –О–О–
–О–О–
молекула активная молекула
кислорода кислорода
Активная молекула кислорода легко вступает в соединение с горючими веществами, не распадаясь на атомы.
СН4 + –О–О–![]() СН3–О–О–Н
СН3–О–О–Н
гидропероксид метила
СН3 -СН3 + –О–О–![]() СН3–О–О–СН3
СН3–О–О–СН3
пероксид диметила
Энергия разрыва связи –О–О– в пероксидах и гидропероксидах значительно ниже (125 — 167 кДж/моль), чем в молекуле кислорода О2, поэтому они весьма реакционноспособны и обычно малоустойчивы. При нагревании и механических воздействиях они легко распадаются с образованием новых веществ или радикалов. Образующиеся при распаде пероксидов радикалы являются активными центрами реакций окисления.
Однако перекисная теория окисления не в состоянии объяснить некоторые характерные особенности процесса окисления, как, например, существование индукционного периода, предшествующего видимой реакции, резкое действие следов примесей на скорость процесса и др. Это было объяснено учением о цепных реакциях.
Цепными называются реакции, идущие через ряд стадий (через ряд промежуточных реакций), в которых образуются промежуточные соединения со свободными валентностями, так называемые активные центры, являющиеся зародышами последующих быстропротекающих стадий процесса.
Впервые представление о цепной реакции появилось в 1913 г., когда немецкий физикохимик М. Боденштейн установил, что при освещении смеси водорода с хлором молекула хлора, поглощая квант световой энергии hv, распадается на атомы
Cl2 + hv = ![]() .
.
Атомы хлора мгновенно вступают в реакцию с водородом, в результате чего происходит взрыв смеси. Активация одной молекулы хлора должна была вызвать образование двух молекул HCl
![]() + Н2 = 2НCl.
+ Н2 = 2НCl.
Однако опыты показывают, что при этом образуется 100 000 молекул хлористого водорода. Это можно объяснить, если предположить, что при взаимодействии атома хлора с водородом образуется продукт, который, вступая во вторичные реакции, вновь возрождается и может продолжать реакцию. Этому предположению соответствует следующая схема реакции:
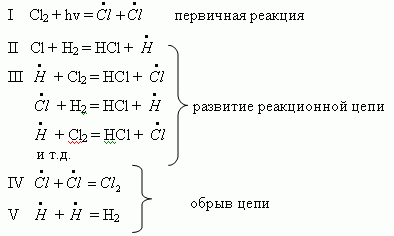
По этой схеме активация одной молекулы хлора (I) вызывает появление двух атомов хлора – двух активных центров цепной реакции. Каждый из атомов хлора дает начало своей цепной реакции, в которой активный центр непрерывно восстанавливается (II, III). Таким образом, под влиянием инициирующей реакции (I) возникают следующие друг за другом реакции, образующие цепь (II, III и т.д.). Число таких реакций от момента зарождения цепи до ее обрыва называют длиной цепи. Цепь может обрываться при
столкновении атомов хлора (IV) или атомов водорода (V) и образовании из них молекул или при столкновении активных центров с поверхностью твердого вещества.
Цепные реакции могут быть разветвляющиеся и неразветвляющиеся (рис. 2.2). Типичной неразветвляющейся цепной реакцией является взаимодействие хлора с водородом. В ней каждый активный центр вызывает появление только одного нового активного центра; поэтому реакция может продолжаться, но не ускоряться. В разветвляющейся цепной реакции каждый активный центр зарождает два или более новых активных центра. Один из новых центров будет продолжать цепь, а второй начинает новую. Примером разветвляющейся цепной реакции может служить реакция водорода с кислородом, протекающая при низких давлениях и температуре около 900 0С.
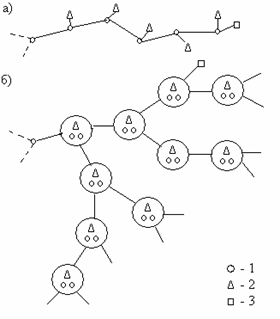 Рис. 2.2. Схема неразветвляющейся (а) и разветвляющейся цепной реакции (б): 1 – активные центры, 2 – продукты реакции, 3 – побочные продукты
Рис. 2.2. Схема неразветвляющейся (а) и разветвляющейся цепной реакции (б): 1 – активные центры, 2 – продукты реакции, 3 – побочные продукты
ЦепьРазветвление
I О2 + Н2 = 2![]() III
III ![]() + О2 =
+ О2 = ![]() +
+ ![]()
II ![]() + Н2 = Н2О +
+ Н2 = Н2О + ![]() IV
IV ![]() + Н2 =
+ Н2 = ![]() +
+ ![]()
Обрыв цепи в объеме
V ![]() + О2 + М
+ О2 + М![]() НО2 + М
НО2 + М
(М – молекула вещества, не участвовавшего в реакции).
Обрыв цепи на стенке
VI ![]() +
+ ![]() + стенка
+ стенка![]() Н2
Н2
В результате реакций (III) и (IV) образуется по два активных центра; следовательно, при этих реакциях цепь разветвляется. Цепные реакции лежат в основе многих химических процессов, в том числе окисления и горения.
Основное отличие современного представления о механизме окисления от перекисной теории состоит в том, что начальной фазой процесса является не активация молекул кислорода, а активация молекул окисляющего вещества.
Начальная температура окисления горючих веществ зависит от структуры их молекул и молекулярной массы. Так, в каждом гомологическом ряду начальная температура окисления гомологов понижается с увеличением их молекулярной массы. Из предельных углеводородов наиболее устойчивым к окислению является метан. Он окисляется только при температуре выше 400 0С. Среди продуктов окисления метана обнаружены муравьиный альдегид, муравьиная кислота и водород. Этан энергично окисляется уже при 400 0С, а нормальный октан – при 250 0С. Углеводороды изостроения окисляются труднее, чем нормальные. Так, если нормальный октан начинает окисляться при 250 0С, то его изомер 2,2,4-триметилпентан в аналогичных условиях начинает окисляться при температуре выше 500 0С. Окисление непредельных углеродов протекает при более высоких температурах, хотя они и имеют двойную связь. Непредельные соединения других классов, например непредельные жирные кислоты, окисляются по месту двойной связи. Окисление ароматических углеводородов происходит при более высоких температурах, чем предельных и непредельных, содержащих то же число углеродных атомов и молекул. Бензол окисляется при температуре выше 500 0С, а гексан — при 300 0С.
Вещества с низкой начальной температурой окисления представляют наибольшую опасность, ибо они способны в процессе окисления самонагреваться, что иногда ведет к возникновению горения.