Для очистки сточных вод используют следующие окислители: газообразный и сжиженный хлор, диоксид хлора, хлорную известь, гипохлориты кальция и натрия, перманганат калия, бихромат калия, перекись водорода, кислород воздуха, пероксосерные кислоты, озон, пиролюзит и др.
В процессе окисления токсичные загрязнения, содержащиеся в сточных водах, в результате химических реакций переводятся в менее токсичные с последующим удалением их из воды. Очистка окислителями связана с большим расходом реагентов, поэтому методы окисления применяются в тех случаях, когда вещества, загрязняющие сточные воды, нецелесообразно или нельзя извлечь другими способами, например, при очистке от цианистых соединений, растворенных соединений мышьяка и др.
Способность веществ проводить окисление определяется величиной окислительного потенциала. Из всех известных в природе окислителей первое место занимает фтор, который, однако, из-за высокой агрессивности не может быть использован на практике. Для других веществ величина окислительного потенциала равна: для озона – 2,07; для хлора – 0,94; для перекиси водорода – 0,68; для перманганата калия – 0,59.
Окисление хлором
Хлор и вещества, содержащие «активный» хлор, являются наиболее распространенными окислителями. Их используют для очистки сточных вод от сероводорода, гидросульфида, метилсернистых соединений, фенолов, цианидов и др. При введении хлора в воду образуется хлорноватистая и соляная кислоты:
С12 + Н2О = НОС1 + НС1
Далее происходит диссоциация хлорноватистой кислоты, степень которой зависит от рН среды. При рН > 4 молекулярный хлор практически отсутствует:
НОС1 ⇄ Н+ + ОСl-
Сумма (Cl2 + HOCl + Ocl-) называется свободным «активным» хлором. В присутствии аммонийных соединений в воде образуется хлорноватистая кислота, хлорамин (NH2C1) и дихлорамин (NHCl2). Хлор в виде хлораминов называется связанным «активным» хлором.
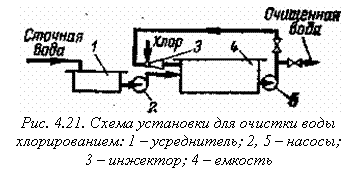
Процесс хлорирования проводят в хлораторах периодического и непрерывного действия, напорных и вакуумных. Хлорирование проводится в емкости 4 (рис. 4.21). В инжекторе 3 газообразный хлор захватывается сточной водой, циркулирующей в системе до тех пор, пока не будет достигнута заданная степень окисления.
При обезвреживании вод от цианидов процесс проводят в щелочной среде при рН ≥ 9. Цианиды можно окислить до элементного азота и диоксида углерода:
CN- + 2ОН- + С12 → CNO- + 2Сl- + Н2О
2CNO- + 4ОН- + 3С12 → СО2 + 6С1- + N2 + 2Н2О
Источниками «активного» хлора могут быть также хлорная известь, гипохлориты, хлораты, диоксид хлора. Хлорную известь получают при взаимодействии хлора с гашеной известью:
Сa(ОН)2 + С12 = СаОС12 + Н2О
Гипохлорит натрия образуется при пропускании газообразного хлора через раствор щелочи:
CI2 + 2NaOH = NaCIO + NaCl
Гипохлорит кальция готовится хлорированием известкового молока при температуре 25…30 °С:
Са(ОН)2 + 2С12 = Са(СlO)2 + СаС12 + 2Н2O
Для очистки сильно загрязненных сточных вод промышленность выпускает двухосновную соль Са(С1О2)∙2Са(ОН) 2∙2Н2О.
Сильным окислителем является хлорат натрия NaClO2, который разлагается с выделением диоксида хлора СlO2. Диоксид хлора является зеленовато-желтым ядовитым газом с более интенсивным запахом, чем хлор. Для его получения используются следующие реакции:
2NaClO2 + Cl2 → 2ClO2 + 2NaCl
5NaCIO2 + 4HCl → 5NaCl + 4С1О2 + 2Н2О
При окислении цианидов «активным» хлором процесс можно проводить в одну ступень до получения цианатов:
СN- + ОСl- → CNO- + Сl- (4.12)
Окисление цианидов до цианатов происходит за счет атомарного кислорода в момент его выделения из окислителя. Образовавшиеся цианаты легко гидролизуются до карбонатов:
СNO- + 2Н2O → CO32- + NH4
Скорость гидролиза зависит от рН среды. При рН = 5,3 за сутки гидролизуется около 80 % цианатов. В двухступенчатом процессе цианиды окисляются до N2 и СО2. На первой ступени процесс протекает по реакции (1.12). На второй ступени вводится дополнительное количество окислителя, и реакция протекает по уравнению:
2CNO- + 3ОСl- + Н2O → 2СO2 + N2 + 2ОH- + 3Сl-
Скорость процесса окисления ускоряется с введением катализаторов – оксидов металлов переменной валентности.
Во время реакций рН поддерживают в пределах 8…11. Контроль полноты окисления производят по остаточному «активному» хлору, концентрация которого должна быть не менее 5…10 мг/л.
Товарная хлорная известь содержит до 33 % «активного» хлора, а гипохлорит кальция – до 60 %. Потребность реагентов (x1) в килограммах в сутки для окисления подсчитывается по формуле:
![]()
где xCl – расход «активного» хлора, необходимого для окисления цианидов, кг/м3; W – расход воды, м3/сут; п – коэффициент избытка реагента (n = 1,2…1,3); α – содержание «активного» хлора в реагенте, в долях единицы.
В качестве окислителя при очистке сточных вод может быть использована перекись водорода, которая является бесцветной жидкостью и в любых соотношениях смешивается с водой. Процесс окисления следует проводить в емкости при интенсивном перемешивании или в барботажном аппарате. Перекисью водорода легко разлагаются нитриты, нитрилы, альдегиды, фенолы, сульфаты.
Обесцвечивание сточных вод
Обесцвечивание сточных вод, содержащих активные красители, при рН = 7…10 протекает с высокой эффективностью. Присутствие катализаторов (солей FeSO4 и CuSO4) ускоряет процесс обесцвечивания в 8…10 раз.
Перспективным является окисление загрязнений пероксосерными кислотами: пероксомоносерной (H2SO5) и пероксодисерной (H2S2O8). Например, фенол окисляется пероксомоносерной кислотой (кислота Каро) при рН = 10. Этим методом можно снизить содержание фенола до 5∙10-6 %. Скорость окисления зависит от соотношения H2SO5 / C6H5OH и повышается с ростом температуры.
Разрушение цианидов под действием пероксосерных кислот протекает также очень быстро. При этом в случае небольших концентраций цианидов (0,01…0,05 %) в сточной воде, используют H2SO5, а при высоких концентрациях – H2S2O8. Оптимальным условиям соответствует рН = 9. В нейтральной среде реакция окисления резко замедляется под действием ионов железа, которые образуют ферроцианы, не подвергающиеся окислению.
Окисление кислородом воздуха
Кислород воздуха используют при очистке воды от железа, для окисления соединений двухвалентного железа в трехвалентное с последующим отделением от воды гидроокиси железа. Реакция окисления в водном растворе протекает по схеме:
4Fe2+ + О2 + 2Н2О = 4Fе3+ + 4ОН-
Fe3+ + 3Н2О = Fe(OH)3 + 3H+
Окисление проводят путем аэрирования воздухом сточной воды в башнях с хордовой насадкой. Образующаяся гидроокись железа отстаивается в контактном резервуаре, а затем отфильтровывается. Возможен процесс упрощенной аэрации. В этом случае над поверхностью фильтра разбрызгивают воду, которая в виде капель падает на поверхность фильтрующей загрузки. При контакте капель воды с воздухом происходит окисление железа.
Окисление пиролюзитом
Окисление пиролюзитом проводят фильтрацией сточной воды через этот материал или в аппаратах с мешалкой. Пиролюзит является природным материалом, состоящим в основном из диосида марганца. Он широко используется для окисления трехвалентного мышьяка в пятивалентный:
H3AsО3 + Mn02 +H2S04 = H3As04 + MnSO4 + Н2О
Повышение температуры способствует увеличению степени окисления. Оптимальный режим окисления следующий: расход MnO2 четырехкратный по сравнению со стехиометрическим расходом, кислотность воды 30…40 г/л, температура воды 70…80 °С.