Молекулярная физика и термодинамика изучают макроскопические процессы в телах, связанные с огромным числом содержащихся в телах атомов и молекул. Для исследования этих процессов применяют два метода: статистический и термодинамический. Первый лежит в основе молекулярной физики, второй – термодинамики.
Молекулярная физика – раздел физики, изучающий те свойства вещества, которые обусловлены его молекулярным строением. В ней рассматриваются превращения вещества, связанные с изменением энергии его молекул, агрегатного состояния тел и др. Молекулярно-кинетическая теория вещества основывается на следующих положениях:
1) Все тела состоят из молекул.
2) Между молекулами существует взаимодействие – притяжение и отталкивание.
3) Молекулы находятся в состоянии непрерывного хаотичного (теплового) движения.
Метод статистической физики основан на том, что свойства макроскопической системы, в конечном счете, определяются свойствами частиц системы, особенностями их движения и усредненными значениями динамических характеристик этих частиц (скорости, энергии…)
Термодинамика – раздел физики, изучающий общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями. Термодинамический метод отличается от статистического тем, что не рассматривает микропроцессы, лежащие в основе этих превращений. Основа термодинамического метода – определение состояния термодинамической системы.
Термодинамическая система – совокупность макроскопических тел, которые взаимодействуют и обмениваются энергией как между собой, так и с другими телами (внешней средой). Состояние системы задается термодинамическими параметрами – совокупностью физических величин, характеризующих свойства термодинамической системы. В качестве параметров состояния выбирают температуру (![]() ), давление (
), давление (![]() ), объем (
), объем (![]() ).
).
Состояние системы называется равновесным, если все параметры системы имеют определенные значения, остающиеся при неизменных внешних условиях постоянными сколь угодно долго. Из состояния термодинамического равновесия систему можно вывести воздействием извне. Если температура в разных точках системы неодинакова, состояние системы неравновесное.
Термодинамическим процессом называется любое изменение в термодинамической системе, связанное с изменением хотя бы одного из ее термодинамических параметров. Процесс есть прохождение системы через последовательность состояний. Если процесс протекает быстро, то это – неравновесные состояния, и процесс называется неравновесным. При медленном протекании процесса в каждый момент времени состояние системы равновесно, и сам процесс является равновесным. Графически можно изобразить только равновесные процессы.
Физические свойства реальных достаточно разреженных газов не зависят от их химической природы. При низких давлениях и высоких температурах реальный газ можно заменить моделью идеального пара, согласно которой:
1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2) между молекулами газа нет сил взаимодействия;
3) столкновения молекул между собой и со стенками сосуда абсолютно упругие.
Поведение идеального газа описывается несколькими законами, установленными опытным путем.
Закон Бойля-Мариотта для изотермического процесса
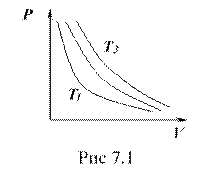 Для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная:
Для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная:
![]() .
.
Зависимость ![]() при
при ![]() изображается на графике кривой (рис. 7.1), которая называется изотермой. На рисунке видно, что чем больше температура, тем выше лежит изотерма:
изображается на графике кривой (рис. 7.1), которая называется изотермой. На рисунке видно, что чем больше температура, тем выше лежит изотерма:
![]() .
.
Закон Гей-Люссака для изобарического процесса
Объем данной массы газа при постоянном давлении изменяется линейно с температурой: ![]()
![]() Здесь
Здесь ![]() – температура по шкале Цельсия,
– температура по шкале Цельсия, ![]() – объем при
– объем при ![]() = 0 oC,
= 0 oC, ![]() град-1.
град-1.
График зависимости ![]() называется изобарой. Он изображен на рис.7.2,
называется изобарой. Он изображен на рис.7.2, ![]() . Чем больше давление, тем выше проходит изобара. При переходе к шкале Кельвина начало отсчета смещается в точку пересечения графика с осью температур, что показано на диаграмме нижней осью температур.
. Чем больше давление, тем выше проходит изобара. При переходе к шкале Кельвина начало отсчета смещается в точку пересечения графика с осью температур, что показано на диаграмме нижней осью температур.
Закон Гей-Люссака для изохорического процесса
Давление данной массы газа при постоянном объеме изменяется линейно с температурой:
![]() ,
,![]() .
.
Здесь ![]() - давление при 0 0С,
- давление при 0 0С, ![]() град-1.
град-1.
 График зависимости p(t) называется изохорой. Он изображен на рис.7.3,
График зависимости p(t) называется изохорой. Он изображен на рис.7.3, ![]() . Чем больше объем, тем выше проходит изохора. Нижняя ось температур на диаграмме соответствует шкале Кельвина.
. Чем больше объем, тем выше проходит изохора. Нижняя ось температур на диаграмме соответствует шкале Кельвина.
Законам Гей-Люссака можно придать другой вид, если перейти от шкалы Цельсия к шкале Кельвина:
при ![]() ,
, ![]() ;
;
при ![]() ,
, ![]() .
.