Для реальных газов необходимо учитывать размеры молекул и их взаимодействие друг с другом. Ван-дер-Ваальс ввел в уравнение Клапейрона-Менделеева две поправки: учел собственный объём и притяжение молекул.
Учет собственного объема молекул
Наличие сил отталкивания, которые противодействуют проникновению в занятый молекулой объем других молекул, сводится к тому, что фактически свободный объем, в котором могут двигаться молекулы реального газа, будет не ![]() , а
, а ![]() –
– ![]() , где
, где ![]() – объем, занимаемый самими молекулами. Объем
– объем, занимаемый самими молекулами. Объем ![]() равен учетверенному собственному объему молекул. Сила отталкивания молекул считается положительной.
равен учетверенному собственному объему молекул. Сила отталкивания молекул считается положительной.
Учет притяжения молекул
Действие сил притяжения газа приводит к появлению дополнительного давления на газ – внутреннего давления. Эти силы принято считать отрицательными. Внутреннее давление равно: 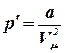
![]() , где
, где ![]() – постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения;
– постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения; ![]() – молярный объем.
– молярный объем.
Вводя эти поправки, получим уравнение Ван-дер-Ваальса для моля газа:
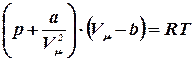 . (9.1)
. (9.1)
Для произвольного количества вещества ν =![]() с учетом того, что V = ν Vμ, уравнение Ван-дер-Ваальса примет вид:
с учетом того, что V = ν Vμ, уравнение Ван-дер-Ваальса примет вид:
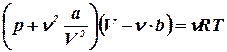 .
.