 Одно и то же вещество может находиться в одном из трех состояний: жидком, твердом, газообразном. Это зависит от соотношения средней кинетической и потенциальной энергий молекул вещества. Если εn<< kТ , то вещество находится в газообразном состоянии. Если εn>> kТ , то вещество находится в твердом состоянии. Если εn = kТ , то вещество находится в жидком состоянии. Здесь εn – наименьшая потенциальная энергия взаимодействия молекул; kТ – удвоенная средняя энергия, приходящаяся на одну степень свободы хаотического теплового движения молекул. Это состояние, в свою очередь, определяется внешними условиями – температурой и давлением. Следовательно, фазовые превращения также определяются изменением температуры и давления.
Одно и то же вещество может находиться в одном из трех состояний: жидком, твердом, газообразном. Это зависит от соотношения средней кинетической и потенциальной энергий молекул вещества. Если εn<< kТ , то вещество находится в газообразном состоянии. Если εn>> kТ , то вещество находится в твердом состоянии. Если εn = kТ , то вещество находится в жидком состоянии. Здесь εn – наименьшая потенциальная энергия взаимодействия молекул; kТ – удвоенная средняя энергия, приходящаяся на одну степень свободы хаотического теплового движения молекул. Это состояние, в свою очередь, определяется внешними условиями – температурой и давлением. Следовательно, фазовые превращения также определяются изменением температуры и давления.
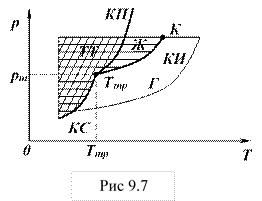
Для наглядного изображения фазовых превращений используется диаграмма состояния, на которой в координатах рТ задается зависимость между температурой фазового перехода и давлением в виде кривых фазового равновесия (рис.9.7). Здесь КП – кривая плавления, КИ – кривая испарения, КС – кривая сублимации.
Каждая кривая фазового равновесия разделяет две фазы. Каждая точка на них соответствует условиям равновесия двух сосуществующих фаз. Кривая КП разделяет твердое тело (ТТ) и жидкость (Ж); кривая КИ разделяет жидкость и газ (Г). Кривая КС разделяет твердую фазу и газообразную. Точка Ттр , в которой пересекаются все кривые и которая определяет условия одновременного равновесного существования трех фаз вещества (температура Ттр и давление ртр), называется тройной точкой. Каждое вещество имеет только одну тройную точку. На диаграмме состояний видно, что кривая испарения заканчивается в критической точке К. Диаграмма состояния дает возможность наблюдать фазовые превращения при изобарных и изотермических процессах.