Изотермы Ван-дер-Ваальса – это кривые зависимости (рис. 9.1) давления (p) от молярного объема газа (Vμ), определяемые уравнением Ван-дер-Ваальса. Как видно на рис. 9.1 с увеличением температуры искажение изотермы уменьшается. При критической температуре (Тк) на изотерме имеется лишь одна точка перегиба К. Соответствующие этой точке давление (рк) и объем (Vк) тоже называют критическими.
Связь между критическими параметрами и поправками Ван-дер-Ваальса описывается следующими соотношениями:
![]() ,
, ![]() ,
, ![]() .
.
где R – универсальная газовая постоянная. Состояние с критическими параметрами (pк, Vk, Тк) называется критическим состоянием.
Решение уравнения Ван-дер-Ваальса (9.1) при заданных параметрах р и Т дает три вещественных корня V1, V2, V3, или два вещественных и один мнимый. Физический смысл имеют лишь вещественные корни.
Проведем анализ изотермы при Т < Тк (рис.9.2). На участках 1-3 и 5-7 с увеличением давления (р) объем (Vμ) уменьшается, что совпадает с изотермой идеального газа и является естественным. На участке 3-5 сжатие газа приводит к уменьшению давления. Такие состояния в природе не осуществляются. При постепенном изменении объема вещество не может оставаться все время в виде однородной среды. В некоторый  момент наступает скачкообразное изменение состояния и распад вещества на две фазы. Таким образом, истинная изотерма имеет вид ломаной линии 7-6-2-1. Участок 7-6 отвечает газообразному состоянию, 2-1 – жидкому. На горизонтальном участке 6-2 наблюдается равновесие жидкой и газообразной фаз вещества.
момент наступает скачкообразное изменение состояния и распад вещества на две фазы. Таким образом, истинная изотерма имеет вид ломаной линии 7-6-2-1. Участок 7-6 отвечает газообразному состоянию, 2-1 – жидкому. На горизонтальном участке 6-2 наблюдается равновесие жидкой и газообразной фаз вещества.
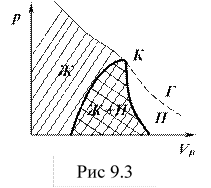 Если через крайние точки горизонтальных участков семейства изотерм (рис.9.1) провести линию, то получится колоколообразная кривая (рис.9.3), ограничивающая область двухфазного состояния вещества.
Если через крайние точки горизонтальных участков семейства изотерм (рис.9.1) провести линию, то получится колоколообразная кривая (рис.9.3), ограничивающая область двухфазного состояния вещества.
Эта кривая и критическая изотерма делят диаграмму ![]() изотермой на 3 области: под колоколом (Ж + П) – область двухфазных состояний (жидкость и насыщенный пар); слева от нее область жидкого состояния (Ж), а справа – область пара (П). Выше критической изотермы находится область газа (Г). Газ отличается от пара тем, что при температуре выше критической не может быть превращен в жидкость ни при каком давлении. Пар же при изотермическом сжатии претерпевает процесс сжижения.
изотермой на 3 области: под колоколом (Ж + П) – область двухфазных состояний (жидкость и насыщенный пар); слева от нее область жидкого состояния (Ж), а справа – область пара (П). Выше критической изотермы находится область газа (Г). Газ отличается от пара тем, что при температуре выше критической не может быть превращен в жидкость ни при каком давлении. Пар же при изотермическом сжатии претерпевает процесс сжижения.