Количественную теоретическую интерпретацию равновесию в системе «осадок соли – раствор» впервые дал В. Оствальд. Он исходил из следующих моментов:
1) в растворе соли существуют не только чистые катионы и анионы, но и другие частицы, которые мы называем сейчас комплексными формами;
2) по закону Бертло-Нернста должно соблюдаться соотношение:
![]() ,
,
где [МАm]тв и [МАm]р-р – концентрации нейтральных молекул в твердой фазе и в растворе.
Поскольку [МАm]тв = const, а [МАm]р-р = bm[Мm+][А-]m, тогда получается выражение:
![]() ,
,
фиксирующее постоянство произведения [Mm+]*[A-]m, которое Оствальд назвал произведением растворимости (ПР).
Применительно к солям более сложного состава МnAm запись произведения растворимости будет иметь вид:
![]() . (3.2)
. (3.2)
Если соль МnAm в растворе полностью диссоциирует на катионы [Mm+] и анионы [An-], уравнение позволяет как рассчитать ПР по известной растворимости, так и решить обратную задачу: – вычислить растворимость по приведенному в справочнике ПР.
Очевидно, что при равновесной растворимости соли S (в моль на литр) концентрации катиона и аниона соответственно равны: [Mm+] = nS, а [An-] = mS. Тогда:
![]() , т.е.
, т.е. 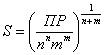 .
.
Добавление в раствор соли с одноименным ионом вызывает уменьшение концентрации иона с противоположным зарядом. Как правило, значительное увеличение концентрации аниона-лиганда приводит к появлению других комплексных форм, которые необходимо учитывать с помощью закомплексованности (Ф). Объединение уравнений (3.1) и (3.2) приводит к выражению:
![]() ,
,
говорящему о более сложной зависимости растворимости соли от концентрации аниона. Классическим примером этой зависимости является зависимость растворимости AgCl, от концентрации хлор-иона.
При решении задач по растворимости, прежде всего, составляют материальный баланс, который применительно к AgCl будет выглядеть следующим образом:
![]() .
.
С помощью констант образования (bi) от этого уравнения можно легко перейти к выражению:
![]() .
.
Рассмотрим примеры решения задач по растворимости AgCl.