Ионы металлов образуют с неорганическими и органическими реагентами большое количество комплексных соединений, свойства которых широко используются в аналитической химии для идентификации, определения и маскирования.
Любое комплексное соединение состоит из центрального атома и координированных вокруг него частиц, которые называются лигандами.
Химическая связь между центральным атомом и лигандом, как правило, носит донорно-акцепторный характер, причем донором пары электронов является лиганд, а акцептором этой пары – центральный атом. Лиганд может иметь несколько донорных атомов, способных образовывать химическую связь с центральным атомом. По этому признаку все лиганды делятся на монодентатные и полидентатные.
Монодентатный лиганд занимает одно координационное место у центрального атома; полидентатный – несколько: два, три и т.д. Максимальное число монодентатных лигандов, которые могут разместиться вокруг центрального атома, носит название координационного числа атома комплексообразователя.
Центральный атом и расположенные вокруг него лиганды образуют внутреннюю координационную сферу, которую иногда называют первой координационной сферой. Внутренняя координационная сфера может иметь положительный, отрицательный или нулевой электрический заряд. Если внутренняя координационная сфера имеет заряд, мы имеем дело с комплексным катионом или анионом, и для электронейтральности комплексное соединение должно содержать анионы или катионы, которые размещаются во внешней или второй координационной сфере. Связь между внутренней и внешней координационными сферами носит чисто ионный характер. Поэтому в водных растворах ионы, находящиеся во внешней координационной сфере комплекса, полностью диссоциированы.
Лиганды представляют собой анионы или полярные молекулы. К неорганическим лигандам относят молекулы воды и аммиака, а также гидроксид-, галогенид-, цианид-ионы и т.д. Одним из наиболее распространенных лигандов является аммиак. Образование аммиачных комплексов наблюдается во всех случаях, когда происходит растворение первоначально образовавшегося осадка гидроксида или основной соли в избытке раствора аммиака. Наиболее устойчивые комплексы образуются с катионами Cu2+, Co2+, Zn2+, Ni2+, Cd2+, Ag+. В случае катионов, обладающих частично заполненной оболочкой, аммиакаты довольно интенсивно окрашены.
Комплексы с органическими лигандами, как правило, интенсивно окрашены, нерастворимы в воде и легко растворимы в органических средах. Обычно лиганды содержат такие донорные атомы, как кислород, азот, сера, фосфор и мышьяк, входящие в состав функциональных групп органических реагентов.
В комплексах с полидентатными лигандами могут образовываться хелатные циклы. Такие комплексы называют хелатами (от греч. chele – клешня краба). Хелаты, в которых замыкание цикла происходит в результате вытеснения ионом металла одного или нескольких протонов из кислотных групп лиганда, называют внутри комплексным и соединениями.
Успех разделения металлов во многих случаях зависит от того, насколько полно удалось перевести определяемый элемент в форму, имеющую большую константу распределения между фазами. В аналитической химии чаще всего для этих целей используется комплексообразование, кислотно-основные и окислительно-восстановительные процессы. Рассмотрим основные закономерности процессов комплексообразования.
Если ион металла поместить в воду, то в первой координационной сфере окажутся молекулы воды, которые образуют прочные химические связи с ионом металла. Мо
лекулы воды из внутренней координационной сферы обмениваются с молекулами воды из объема раствора, причем этот процесс может быть как очень быстрым, так и очень медленным.
Кинетику этого процесса можно изучать, используя меченую изотопом О18 воду. В настоящее время имеются достоверные экспериментальные данные о том, что в первой координационной сфере ионов металлов находится строго определенное число молекул воды: 2, 4, 6 или 8. Такие ионы носят название аквоионов.
Если в раствор, содержащий аквоионы, ввести частицы, обладающие большими донорными свойствами, нежели молекулы воды, то они будут вытеснять координированные молекулы воды и, таким образом, процесс комплексообразования в водном растворе будет сводиться к реакции замещения молекул воды в аквоионе на молекулы или ионы лиганда. Процесс может быть записан следующим образом:
![]() ;
;
с константой равновесия
![]() .
.
Здесь и далее заряды комплексной частицы и лигандов мы опускаем для упрощения записи.
Образование комплексной частицы MLn проходит ступенчато, т.е. молекулы лиганда последовательно замещают молекулы воды одну за другой, вплоть до полного вытеснения их из внутренней координационной сферы. Каждая ступень равновесия характеризуется ступенчатой или частной константой (Ki). Весь процесс характеризуется полной или общей константой (bn).
Нетрудно видеть, что bn=K1*K2*…*Kn. Уравнение материального баланса будет следующим:
для лиганда
![]() ,
,
для металла
![]() .
.
Здесь СL и СМ – аналитические или полные концентрации, а в квадратных скобах равновесные концентрации соответствующих частиц.
Таким образом, мы видим, что металл может находиться в растворе в виде различных комплексных частиц, причем соотношение между ними может быть любым. Для характеристики глубины комплексообразования Бьеррумом было введено понятие среднего координационного числа (![]() ). Это число лигандов, связанных с ионом металла и приходящиеся в среднем на его один атом:
). Это число лигандов, связанных с ионом металла и приходящиеся в среднем на его один атом:
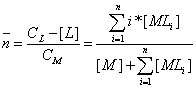 .
.
Совершенно очевидно, что, если лиганда нет в растворе, тогда
СL = 0 и [L] = 0 и ![]() = 0;
= 0;
при добавлении лиганда часть его идет на образование комплексных частиц, а часть остается в растворе несвязанной, т.е. равновесной и ![]() растет; по мере увеличения концентрации лиганда во все большей мере образуется комплексная частица, содержащая
растет; по мере увеличения концентрации лиганда во все большей мере образуется комплексная частица, содержащая
максимальное количество лигандов, и, наконец, когда весь металл окажется в этой форме, дальнейшее увеличение концентрации лиганда не будет приводить к увеличению количества связанного лиганда, и ![]() достигнет своего предела, равного максимальному координационному числу. Обратим внимание, что
достигнет своего предела, равного максимальному координационному числу. Обратим внимание, что ![]() может принимать любые значения между 0 и n, как целочисленные, так и дробные.
может принимать любые значения между 0 и n, как целочисленные, так и дробные.
В выражении для среднего координационного числа (![]() ) величины равновесных концентраций комплексных частиц можно заменить, используя константы bI, тогда получим:
) величины равновесных концентраций комплексных частиц можно заменить, используя константы bI, тогда получим:
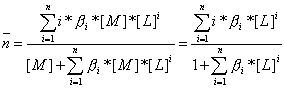 .
.
Таким образом, оказывается, что для одноядерных комплексов глубина комплексообразования, характеризуемая средним координационным числом, является только функцией равновесной концентрации лиганда.
Для того, чтобы рассчитать распределение металла по различным комплексным формам, необходимо иметь данные о ступенчатых константах образования и равновесной концентрации лиганда. Равновесную концентрацию лиганда нужно либо измерить подходящим методом, либо рассчитать. Если константы образования малы и СM << СL, то часто пользуются приближением [L] ~ СL, однако при этом всегда следует давать себе отчет в том, насколько справедливо это приближение.
Поскольку процессы комплексообразования представляют собой реакции замещения, их можно разделить на два класса: изозарядное замещение и неизозарядное замещение. Если замещаемый и замещающий лиганды имеют одинаковые электрические заряды, то говорят об изозарядном замещении, при этом, разумеется, общий заряд комплексной частицы не может измениться. Если замещаемый и замещающий лиганды имеют разные электрические заряды, то говорят о неизозарядном замещении, в ходе которого комплексная частица, естественно, меняет электрический заряд.
Так, замещение воды в аквоионе меди на аммиак является изозарядным процессом, потому что и молекула воды, и молекула аммиака имеют одинаковые нулевые заряды; комплекс как был катионом до замещения, так и остался им после замещения, а замещение хлорид-иона в AuCl4- на воду является неизозарядным процессом, поскольку молекула воды имеет нулевой электрический заряд.
Как всякая константа, константа образования может быть пересчитана в изобарно-изотермический потенциал:
![]() .
.
При этом выясняется, что для многих процессов ступенчатого комплексообразования DНi – небольшая и постоянная величина. В чем же причина изменения константы при переходе от одной ступени к другой? Чем определяется величина ![]() , именуемая ступенчатым фактором. Если мы знаем эти закономерности, то довольно легко можем оценить значения ступенчатых констант, а, зная величину общей константы, можем решить обратную задачу.
, именуемая ступенчатым фактором. Если мы знаем эти закономерности, то довольно легко можем оценить значения ступенчатых констант, а, зная величину общей константы, можем решить обратную задачу.
Допустим, что способность соединения MLn к отщеплению лиганда пропорциональна n, а способность к присоединению лиганда пропорциональна n-i, т.е. первый процесс пропорционален числу уже присоединившихся лигандов, а второй процесс пропорционален числу вакантных мест.
Тогда для двух соседних форм отношение констант этих ступеней будет пропорционально:
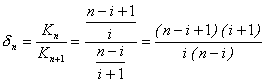 .
.
Так, для n = 2 ![]() , т.е. константа первой ступени равновесия в четыре раза больше второй, если соотношение между константами определяется только этой причиной.
, т.е. константа первой ступени равновесия в четыре раза больше второй, если соотношение между константами определяется только этой причиной.
Таким образом, можно думать, что в любую константу входит статистический член, равный отношению вероятностей отщепления и присоединения лигандов:
![]() ,
,
тогда ступенчатую константу можно представить как ![]() .
.
Статистический фактор не зависит от природы частиц, а потому не имеет никакого отношения к химии, но, тем не менее, он содержится в любой ступенчатой константе. Если мы исключим статистические факторы из всех констант, то получим новые константы без учета статистики, в этом случае отношение ![]() называют лиганд-эффектом.
называют лиганд-эффектом.
Часто отношение последовательных констант представляют в логарифмической форме:
![]() .
.
Что же мы знаем о лиганд-эффекте? Оказывается, для большинства известных изозарядных процессов
![]() , т.е.
, т.е. ![]() ,
,
отсюда
![]() .
.
Статистическое соотношение констант наблюдается во всех случаях, когда химическая природа замещаемых и замещающих лигандов не сильно отличается друг от друга. Так, при замещении Сl- на Br- независимо от металла комплексообразователя ход ступенчатых констант чисто статистический, но при замещении одного из этих лигандов на СN- появляется лиганд-эффект, отличный от нуля. Образование аминов металлов из аквокомплексов часто также подчиняется статистике. Обнаруженные при этом лиганд-эффекты не значительны, что вполне понятно, поскольку молекулы воды и аммиака имеют близкие размеры, дипольные моменты и поляризуемости.
Для неизозарядных процессов лиганд-эффект не равен нулю, ![]() и
и ![]() , что заставляет думать, что в лиганд-эффект входит электростатистическая составляющая, тогда как в изозарядном процессе она по определению равна нулю. Учет этой составляющей весьма сложен. Некоторыми авторами было показано, что после учета электростатистической составляющей лиганд-эффект неизозарядных процессов, как и изозарядных оказывается весьма малой величиной.
, что заставляет думать, что в лиганд-эффект входит электростатистическая составляющая, тогда как в изозарядном процессе она по определению равна нулю. Учет этой составляющей весьма сложен. Некоторыми авторами было показано, что после учета электростатистической составляющей лиганд-эффект неизозарядных процессов, как и изозарядных оказывается весьма малой величиной.
Не следует думать, что во всех случаях жизни лиганд-эффект либо равен нулю, либо представляет собой весьма малую величину. В лиганд-эффекте отражается различие в химической сущности протекающих процессов, а потому он оказывается весьма большим, когда происходят существенные химические изменения при переходе от од
ной ступени к другой, например, изменение характера химической связи, перестройка геометрической структуры частицы и т.п.
В настоящее время химия координационных соединений является одной из самых динамичных отраслей знания. Число координационных соединений реально начинает соперничать с числом органических соединений; открытие новых классов соединений, новых методов исследования, создание новых теоретических концепций происходит практически ежегодно; в этом потоке информации вряд ли есть надежда, что обнаружатся общие и в то же время достаточно конкретные закономерности, позволяющие предсказывать величины констант образования различных комплексов.
Поэтому химики выбирают более простой путь: неизвестную константу образования определяют экспериментально; далее в ряду родственных соединений по известным уже константам ищут закономерность, которая обладает определенной предсказательной силой в рамках определенного класса соединений или реакций.
Точно предсказать комплексообразующую способность элемента невозможно, даже пользуясь таким фундаментальным законом химии, как периодический закон. По-видимому, это отражает тот факт, что процессы комплексообразования связаны с очень тонкими различиями в химическом поведении элементов, и комплексообразующая способность элемента зависит как от его степени окисления, так и от природы лигандов.
В общих чертах можно утверждать, что наименьшую способность к комплексообразованию проявляют элементы нулевой группы и прилегающие к ней элементы главных подгрупп первой и седьмой группы. Наибольшая комплексообразующая способность характерна для элементов 8-й группы таблицы Менделеева. В развернутом варианте периодической таблицы наиболее типичные комплексообразователи оказываются сосредоточенными в центре таблицы.
Для главных подгрупп при одинаковом ионном радиусе устойчивость комплексов нарастает с ростом заряда; при равном заряде с ростом ионного радиуса устойчивость уменьшается. Для побочных подгрупп первое положение остается справедливым, тогда как второе меняет знак, т.е. устойчивость возрастает с ростом ионного радиуса при постоянном заряде.
Для двухзарядных металлических ионов первого переходного ряда от Mn2+ до Zn2+ по величине первой константы образования K1, с очень широким кругом лигандов был установлен следующий порядок устойчивости:
![]() .
.
Этот ряд получил название ряда Эрвинга-Вильямса. Такое изменение устойчивости хорошо коррелирует с изменением второго ионизационного потенциала в этом ряду. Наличие хорошей корреляции, по-видимому, объясняется тем, что энергия образования химической связи представляет собой, по сути, неполную компенсацию затрат на ионизацию атома. Распространение этой закономерности на элементы второго и третьего переходных рядов уже не подтверждается экспериментальными данными, что и указывает на ограниченный характер этой закономерности.
Если рассматривать процесс комплексообразования со стороны лиганда, то, прежде всего, следует отметить, что ряд лигандов не обладает специфичностью по отношению к определенным ионам металла. Сюда прежде всего относятся: вода, гидроксильный ион, ион О2- и в некоторой мере F-. С этими лигандами все металлические ионы образуют более или менее устойчивые комплексы. Другой тип лигандов, например, молекулы, содержащие донорные атомы серы, обладают ярко выраженной специфичностью по отношении к определенным ионам металлов. Так, дитизон образует чрезвычайно устойчивые комплексы с ртутью (II) и не образует устойчивых комплексов с магнием (II).
Для ионов переходных металлов было обнаружено, что, если проводить сравнение устойчивости галогенидных комплексов по величинам bn или ![]() , то можно выделить два класса металлов. Последовательность устойчивости определяется:
, то можно выделить два класса металлов. Последовательность устойчивости определяется:
для первого класса порядком ![]() ;
;
для второго – ![]() .
.
Первый ряд был назван обычным рядом устойчивости, а второй – обращенным. Эта закономерность была проверена на молекулах лигандов, содержащих донорные атомы: O, S, Se, Te, N, P, As, Sb. Оказалось, что во всех случаях имеется прямой и обращенный ряд устойчивости.
Те металлы, которые дают наиболее прочные комплексы с молекулами, содержащими донорные атомы F, О и N, т.е. металлы, дающие обычный ряд устойчивости, были названы металлами класса «А». Металлы, которые образуют прочные комплексы с лигандами, содержащими донорные атомы I, Te и Sb, т.е. металлы, дающие обращенный ряд устойчивости, были названы металлами класса «Б».
Металлы класса «Б» в развернутой форме периодической таблицы занимают область, напоминающую некоторым образом треугольник, причем вершина его лежит на никеле и меди, а основание треугольника простирается от осмия до висмута. Следует сказать, что, чем ниже в периодической системе находится металл, чем меньше его координационное число и чем больше степень окисления, тем выше обращенность и тем бесспорнее принадлежность этого металла к классу «Б».
При образовании хелатов акволиганды гидратированного катиона вытесняются донорными атомами хелатного лиганда. Эти представления нельзя перенести на высокозаряженные катионы небольшого размера, которые в водных растворах существуют не в виде аквоионов, а в виде оксоанионов и оксокислот.
Оксо- и гидроксолиганды вытесняются из внутренней сферы лишь немногими некислородными лигандами, например, ионом F-. Несмотря на это, высокозаряженные центральные атомы иногда образует истинные, довольно стабильные хелаты; однако их поведение отличается от поведения обычных хелатов.
В противоположность обычным хелатам, они устойчивы только в сильнокислых растворах, часто образуются даже в концентрированных кислотах и быстро разрушаются в щелочных растворах. Образование таких хелатов можно представить как образование эфира недиссоциированной гидрокислоты со спиртовыми или фенольными ОН-группами хелатного лиганда.
Особенностью хелатных комплексов является то, что они, как правило, более устойчивы по сравнению с аналогичными комплексами, образованными тем же ионом металла с монодентатными лигандами. Шварценбахом было введено понятие «хелатный эффект» для того, чтобы отразить это явление относительно более высокой устойчивости хелата металла по сравнению с аналогичными комплексами металлов с монодентатными лигандами или с хелатообразующими реагентами, но с меньшим числом хелатных циклов. Хелатный эффект определяется разностью величин lgK для сравнимых комплексов:
![]() .
.
Для корректного сравнения необходимо, чтобы донорные атомы лигандов Z и А были одинаковы.
Для металлических ионов первого переходного ряда при сравнении устойчивости этилендиаминовых и аммиачных комплексов значения хелатного эффекта в ряду: Co2+, Ni2+, Cu2+ и Zn2+ составляет 2,3; 2,5; 3,0 и 1,2 логарифмической единицы соответст
венно. При переходе к пропилендиамину для Ni2+ и Cu2+ значения хелатного эффекта уменьшаются до 1,4 и 2,3 логарифмических единиц.
Таким образом, оказывается, что пятичленные циклы более устойчивы, чем шестичленные, а при образовании семичленных циклов хелатный эффект практически равен нулю. Пока неизвестны молекулы лигандов, содержащие донорные атомы азота и способные образовывать четырехчленные циклы в хелате. Гидразин, потенциально могущий дать трехчленный цикл, оказывается, ведет себя как монодентатный лиганд. Таким образом, можно думать, что хелатный эффект в такого рода соединениях либо равен нулю, либо отрицателен.
Первоначальное объяснение природы хелатного эффекта было следующим. Уравнения образования комплексов можно записать так:
![]() ;
;
![]() .
.
В первом процессе из раствора уходит четыре молекулы аммиака и высвобождается четыре молекулы воды, т.е. число частиц остается неизменным. Во втором процессе на две молекулы этилендиамина высвобождаются те же четыре молекулы воды, число частиц в растворе растет, что приводит к росту энтропии системы, следовательно, существование хелатного эффекта может быть объяснено целиком энтропийным фактором.
Хотя энтропийный вклад в образование хелата всегда существует, количественное сопоставление величин хелатных эффектов приводит к тому, что мы должны признать существование и энтальпийной части его. Значение хелатного эффекта определяется следующими факторами:
|
энтропийный вклад |
энтальпийный вклад |
|
1) числом хелатных циклов; 2) размером циклов; 3) изменением сольватации частиц при образовании комплекса; 4) расположением хелатных циклов; 5) изменением энтропии некоординированных лигандов; 6) изменением энтропии координированных лигандов |
1) теплотой образования связи иона металла с лигандом, которая определяется электроотрицательностью иона металла и донорного атома лиганда; 2) структурой лиганда; 3) стерическим и электростатическим отталкиванием между донорными группами лигандов в комплексе; 4) кулоновским взаимодействием центрального иона с лигандами |
Важнейшими факторами, которые характерны для образования хелатов и которые отличают хелатообразование от образования комплексов вообще, являются число хелатных циклов и размеры циклов.
Хотя сам процесс комплексообразования в водных растворах является реакцией замещения, образующиеся комплексные частицы могут участвовать еще в двух типах химических реакций, а именно, в кислотно-основных процессах, связанных с передачей протона, и окислительно-восстановительных, связанных с передачей электронов.
Любой аквоион металла, в соответствии с основными положениями теории кислот и оснований Бренстеда, должен быть кислотой, поскольку может быть поставщиком протонов.
Например, для аквоиона алюминия(III) процесс может быть записан следующим образом:
![]() ;
;
![]() ;
;
![]() .
.
Обычная форма записи выглядит так:
![]() ,
,
но она отражает не существо дела, а стремление к краткости записи.
Сама молекула воды обладает кислотными свойствами и имеет константу диссоциации порядка 10-16. При координации вблизи заряженного иона металла, естественно, способность ее к диссоциации должна возрасти. Так, в случае аквоиона А1(III) мы имеем рК1=4,9; Fе(III) – 2,5; Cr(III) – 4,0; Mg(II) – 12,1; Ca(II) – 12,8; Cu(II) – 7,0; Ag(I) – 11,7; Hg(II) – 2,8. Из этих данных видно, что способность к диссоциации координированных молекул воды увеличивается на 3 – 13 порядков, причем, чем выше заряд иона, тем сильнее кислота.
Процесс кислотной диссоциации аквоиона формально можно рассматривать как процесс замещения координированных молекул воды на гидроксильный ион:
![]() ;
;
с константой равновесия
![]() ,
, ![]() .
.
Если теперь учесть константу автопротолиза воды:
![]() ,
, ![]()
то видно, что ![]() .
.
Таким образом, термодинамически безразлично, как описывать кислотные свойства аквоионов: в виде процесса диссоциации или замещения на гидроксильный ион. Решить вопрос о том, как же в действительности идет процесс, помогают кинетические исследования. Дело в том, что процессы диссоциации идут с очень большими скоростями, тогда как скорости реакций замещения на несколько порядков меньше. Это позволяет утверждать, что в большинстве случаев реализуется механизм диссоциации.
Кислотные свойства координированной молекулы зависят не только от общего заряда комплекса, но и от ближайшего окружения во внутренней координационной сфере. Так, например, [Со(Н2О)6]3+ – очень сильная кислота, тогда как [Со(NН3)5Н2O]3+ имеет рК1 ~ 5. Аквоион Rh(III) [Rh(Н2O)6]3+ – кислота средней силы с рК1 ~ 3, в то время, как ион [RhCl5Н2O]2- – очень слабая кислота с рК1 ~ 8.
При оценке кислотных свойств комплексных соединений следует всегда иметь в виду, что способность лиганда отщеплять протон при координации всегда возрастает, если он находится вблизи донорного атома. Например, вода увеличивает свои кислотные свойства, сероводород и галогеноводородные кислоты ведут себя таким же образом, поэтому комплексные кислоты оказываются более сильными кислотами, нежели обычные.
Положение меняется, когда между донорным атомом и протонсодержащей группой находится хотя бы еще один атом, который не может передавать влияние центрального иона. Например, аминокислоты могут координироваться не только биден
татно, но и монодентатно, причем координация осуществляется через атом азота аминогруппы. Кислотные свойства некоординированной карбоксильной группы оказываются такими же, как и в некоординированной кислоте. Причина этого заключается в том, что группа СН2 не передает влияние центрального иона на карбоксильную группу.
Заканчивая рассмотрение кислотных свойств комплексов, можно поставить вопрос: каким образом рН среды влияет на процессы комплексообразования? Здесь можно выделить два случая:
· первый, когда лиганд является анионом сильной кислоты;
· второй, когда он представляет собой анион слабой кислоты.
В первом случае нет специфического влияния концентрации водородного иона, она влияет так же, как и изменение концентрации любого другого иона через изменение коэффициентов активности. Во втором случае процесс представляет собой сопряженные процессы диссоциации слабой кислоты и образования комплекса:
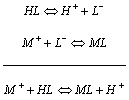
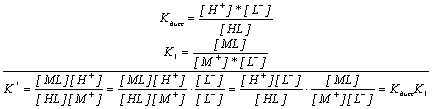 .
.
Глубина образования МL однозначно определяется равновесной концентрацией [L-], которую следует определить из уравнения диссоциации слабой кислоты.
Роль рН в этом процессе сводится к созданию определенной равновесной концентрации лиганда и, тем самым, определяет глубину комплексообразования. В кислых средах [L-]®0, и комплекс не образуется, в щелочных средах [L-]®СL, и глубина комплексообразования будет определяться только значением K1 при заданном значении СL.
Комплексные соединения участвуют в окислительно-восстановительных реакциях, отличительной чертой которых является передача электронов от восстановителя к окислителю. Каким же образом комплексообразование влияет на окислительный потенциал частицы? Как известно, окислительный потенциал системы определяется из уравнения Нернста:
![]() .
.
Для системы Аg+/Ag° это уравнение будет выглядеть:
![]() ,
,
поскольку [Ag°] – это собственная растворимость металлического серебра, то ![]() – величина постоянная и может быть объединен с
– величина постоянная и может быть объединен с ![]() . Тогда имеем:
. Тогда имеем:
![]() .
.
Если в систему Аg+/Ag° ввести лиганд, например аммиак, то ионы серебра будут связываться в комплекс, равновесная концентрация серебра будет падать и окислительный потенциал будет понижаться:
![]() ;
; ![]() .
.
Откуда
![]() , (4.1)
, (4.1)
где
![]() .
.
Из уравнения (4.1) видно, что окислительный потенциал уменьшается с ростом равновесной концентрации лиганда, а нормальный стандартный потенциал комплексной формы отличается от стандартного потенциала аквоиона на величину ![]() .
.
Отсюда открывается возможность регулировать окислительную способность иона путем простой замены ближайшего окружения, т.е. путем проведения реакций комплексообразования. Так, за счет реакций комплексообразования мы можем превратить один из самых сильных окислителей аквоион золота(I) [Au(H2O)2]+ (E0 = 1,68 В) в сильный восстановитель – цианидный комплекс золота(I) [Au(CN)2]‑ (E0 = -0,60 В).
Если концентрация восстановленной формы в уравнении Нернста не является постоянной величиной, как, например, для системы Fe3+/Fe2+, предсказать изменение окислительных свойств труднее. Уравнение Нернста для системы имеет следующий вид:
![]() .
.
В том случае, когда лиганд образует более прочные комплексы с ионом Fe3+, потенциал будет падать, если же прочнее комплексы с ионом Fe2+, потенциал будет расти, по сравнению с потенциалом аквоионов.
Заканчивая обсуждение вопросов комплексообразования, можно сказать, что эти процессы дают в руки аналитика очень эффективные средства тонкой регулировки химической природы частиц. С их помощью катионы можно превращать в анионы или нейтральные частицы, сильно гидратированные ионы – в ионы слабо гидратированные, гидролизующиеся ионы – в ионы негидролизующиеся и, наконец, окислители – в восстановители. Все это привело к тому, что в настоящее время подавляющее большинство химиков-аналитиков занимается проблемами координационной химии.