Процесс нагревания или охлаждения может происходить при различных условиях. Рассмотрим процесс нагревания газа одного и того же количества (1 кг) в одинаковых цилиндрах с одинаковыми начальными параметрами (рис. 5.1).
В обоих цилиндрах газ будем нагревать до одинаковой температуры Т2. В первом цилиндре (рис.5.1, а) теплота будет подводиться при постоянном объеме, т.е. процесс будет изохорным. Во втором цилиндре (рис.5.1, б) газ будет расширяться от v1 до v2 при постоянном давлении (р), т.е. процесс будет изобарным.
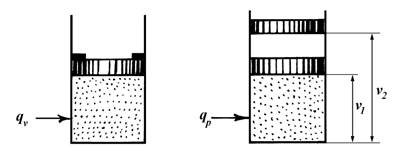
Рис. 5.1. Изохорный (а) и изобарный (б) процессы
Так как в первом случае газ не расширяется, он не совершает работу и поэтому вся подводимая теплота тратится на повышение внутренней энергии и на повышения давления. Удельное количество теплоты можно определить по формуле:
![]() .
.
Во втором цилиндре подведенная к газу теплота расходуется как на повышение температуры, так и на перемещение поршня (т.е. на совершение работы). Удельное количество теплоты в этом случае можно определить по формуле:
![]() . (5.2)
. (5.2)
Подогрев газа в обоих цилиндрах идет до одинаковой температуры Т2, но во втором случае теплоты необходимо затратить больше на величину работы l, совершенной для перемещения поршня. Тогда:
![]() или
или ![]() .
.
Известно, что работа (l) при р = const составляет:
![]() или
или ![]() .
.
Так как ![]() , то
, то ![]() . Следовательно, имеем:
. Следовательно, имеем:
![]() .
.
откуда
![]() . (5.3)
. (5.3)
Полученная связь между изобарной и изохорной теплоемкостями (5.3) называется уравнением Майера. Зная зависимость между теплоемкостями, можно записать:
![]() .
.
Таким образом, в зависимости от того к какой количественной единице вещества относится теплоемкость, различают следующие виды изобарной и изохорной теплоемкостей:
![]() – массовые изобарная и изохорная теплоемкости;
– массовые изобарная и изохорная теплоемкости;
![]() – объемные изобарная и изохорная теплоемкости;
– объемные изобарная и изохорная теплоемкости;
![]() – мольные изобарная и изохорная теплоемкости.
– мольные изобарная и изохорная теплоемкости.
В термодинамических расчетах часто встречается величина (![]() ), называемая показателем адиабаты и равная отношению изобарной теплоемкости к изохорной:
), называемая показателем адиабаты и равная отношению изобарной теплоемкости к изохорной:
![]() .
.
Значение показателя адиабаты зависит от температуры, но для газов и паров эта зависимость незначительна, и ею пренебрегают, принимая ![]() величиной постоянной. Для идеальных газов значение показателя адиабаты принимают равным:
величиной постоянной. Для идеальных газов значение показателя адиабаты принимают равным:
· одноатомных газов – 1,67;
· двухатомных газов – 1,4;
· трех- и многоатомных газов – 1,29.
Точные значения ![]() для некоторых газов и водяных паров приводятся в справочниках в зависимости от их температур.
для некоторых газов и водяных паров приводятся в справочниках в зависимости от их температур.