Проблема медленного распада отходов существует не только для веществ органического происхождения, но и для веществ неорганического происхождения. В первую очередь, это обнаруживается при загрязнении воды хлоридами, минеральными удобрениями, соединениями тяжелых металлов и кислотами. Некоторые вещества, например, тяжелые металлы, даже после извлечения их из первоначальных соединений сохраняют свою токсичность.
Ионы, поступающие из удобрений и солей, используемых для снеготаяния при уборке снега и льда
Для таяния льда, как правило, используют поваренную соль, которая в широком диапазоне концентраций нетоксична для большинства живых существ. Но благодаря высокому осмотическому давлению, проявляющемуся при концентрации солей, достигающей несколько сотен миллиграмм на литр, может нарушаться нормальное функционирование осмотических систем в пресной воде. Только некоторые виды живых существ имеют такую подвижную систему осмотического регулирования, что они безболезненно переносят большие перепады осмотического давления, например, могут перемещаться из морской воды в пресную речную и обратно.
Обычно пресная вода содержит 2 – 10 мг хлоридов на литр. Морская вода содержит значительно больше солей. В Северном море, например, содержание хлоридов составляет около 19 000 мг/л. Некоторые реки в настоящее время так загрязнены солями, что это вызывает глубокие экологические изменения. К главным источникам загрязнений хлоридами относятся в этом случае сточные воды соляных рудников, а также потоки соленой воды на улицах и автострадах в зимнее время. В то время как воды соляных разработок постоянно сохраняют высокую концентрацию солей, зимние потоки на улицах и выбросы солей в водоемы носят сезонный характер.
В Средней Европе к числу рек с особенно большой загрязненностью хлоридами относится река Верра (ФРГ); уже в середине 1970-х годов средняя концентрация солей в ней составляла около 17 000 мг/л. В подобных условиях гибнут все рыбы. Помимо реки Верра к сильно загрязненным хлоридами рекам относятся: Везер, Рейн и Мозель.
Для внутренних водоемов нет общепринятых норм для хлоридов, допустимая засоленность зависит от общей загрязненности воды. Например, для р. Верра максимально допустимая концентрация хлоридов составляет 2500 мг/л в то время, как в более загрязненной р. Везер эта концентрация не должна превышать 2000 мг/л.
Содержание хлоридов в воде определяет и ее пригодность для питья. Для питьевой воды предельное значение составляет 200 мг/л. Вода с большим содержанием либо солона, либо горька на вкус. Содержание хлоридов в воде также определяет возможность её использования в сельском хозяйстве, в том числе для парников и оранжерей. В зависимости от вида растений предельная концентрация хлоридов составляет 50 – 300 мг/л.
Совсем иначе, чем хлориды, на воду действуют удобрения. Обычно хорошо растворимые в воде удобрения вымываются обильными дождями, попадая в грунтовые и поверхностные воды (водоемы). В наиболее распространенных удобрениях ионы К+ и Са2+ можно
считать безвредными, так как их концентрация в природной воде (грунтовых водах и водоемах) не опасна для живых существ и не наносит ущерба природной среде.
Напротив, ионы ![]() способствуют зарастанию водоемов растительностью. Уже 10 мг фосфата на 1 м3 воды приводят к заметному росту растительности, вызывая разрастание планктона.
способствуют зарастанию водоемов растительностью. Уже 10 мг фосфата на 1 м3 воды приводят к заметному росту растительности, вызывая разрастание планктона.
Наряду с удобрениями источником фосфатов служат и моющие средства. Нитраты и фосфаты попадают в воду также в результате микробиологического разрушения органических отходов.
При высоких значениях рН фосфаты выпадают в осадок в виде солей кальция и железа, что снижает эффект зарастания водоемов.
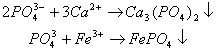
При создании в воде анаэробной среды и росте содержания восстановителей в результате процессов брожения выпавший в осадок фосфат железа (III) восстанавливается до фосфата железа (II), после чего зарастание водоемов вновь усиливается.
Растворимые соединения азота не только способствуют зарастанию водоемов; попадая в питьевую воду, они могут оказывать токсичное действие на людей. Проникая вместе с пищей в слюну и тонкие кишки, нитраты микробиологически восстанавливаются до нитритов, в результате, в крови образуется нитрозил-ионы:
NO3- + H2 ![]() NO2 – + H2O
NO2 – + H2O
![]()
![]() NO+ + OH -
NO+ + OH -
Нитрозил-ионы могут окислять железо (II) в гемоглобине до железа (III), что препятствует связыванию кислорода гемоглобином при образовании координационной связи между железом и кислородом:
Fe2+ + NO+ → Fe3+ + NO
В результате, возникают симптомы кислородной недостаточности, приводящей к цианозу (синюхе). При переходе 60 – 80 % железа (II) гемоглобина в железо (III) наступает смерть. Особенно чутко на нитрозил-ион реагируют грудные младенцы в первые недели своей жизни. У них недостаточно проявляется деятельность гемоглобинредуктазы, восстанавливающей железо (Ш) в железо (II). У взрослых этот процесс идет активнее, и в результате организм не так остро реагирует на присутствие нитратов и нитритов. Тем не менее, и взрослые должны избегать чрезмерных количеств нитратов и нитритов.
Нитриты расширяют сосуды и образуют в кислой среде желудка азотистую (HNO3) кислоту, обладающую мутагенным действием. Кроме того, нитриты в кислой среде образуют в желудке вместе с органическими аминами из растительной и животной пищи нитрозамины, также обладающие мутагенным действием:
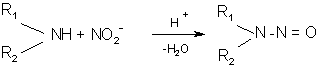
Тяжелые металлы
К числу важнейших факторов, обусловливающих загрязнение воды, относятся тяжелые металлы. Попадание в воду тяжелых металлов обусловлено деятельностью целого ряда отраслей промышленности (табл. 8.2.)
Поскольку тяжелые металлы содержатся также и в бытовых отходах, существует опасность, что они могут попадать из свалок в грунтовые воды и водоемы.
Попавшие в воду соединения тяжелых металлов быстро распространяются по большому объему. Частично они выпадают в осадок в виде карбонатов, сульфатов или сульфидов, частично адсорбируются на минеральных и органических осадках:
|
Zn2+ + HS- |
|
ZnS↓ + H+ |
|
CdCl+ + HS- |
|
CdS↓ + H+ + Cl- |
Поэтому содержание тяжелых металлов в отложениях постоянно растет. Многочисленные наблюдения показали, что в ФРГ содержание тяжелых металлов в донных осадках рек и морей в 100 – 1000 раз превышает их содержание в воде. Исследования на Рейне и Баденском озере показали, что содержание тяжелых металлов в осадках неизменно растет с ростом производства этих металлов.
Таблица 8.2
Выбросы тяжелых металлов различными отраслями промышленности
|
Источник |
Тяжелые металлы |
|||||||
|
Cs |
Cr |
Cu |
Hg |
Pb |
Ni |
Sn |
Zn |
|
|
Целлюлозно-бумажная промышленность |
+ |
+ |
+ |
+ |
+ |
+ |
||
|
Горно-добывающая промышленность |
+ |
+ |
+ |
+ |
+ |
+ |
||
|
Производство хлора и щелочей |
+ |
+ |
+ |
+ |
+ |
+ |
||
|
Производство удобрений |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
|
Очистка нефти |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
|
Производство стали |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
|
Цветная металлургия |
+ |
+ |
+ |
+ |
+ |
+ |
||
|
Авто- и авиастроение |
+ |
+ |
+ |
+ |
+ |
|||
|
Производство стекла, цемента, керамики |
+ |
|||||||
|
Текстильная промышленность |
+ |
|||||||
|
Кожевенная промышленность |
+ |
|||||||
|
Паросиловые установки |
+ |
+ |
||||||
Особенно напряженная ситуация может возникнуть, если адсорбционная способность осадков будет исчерпана. Этот момент нельзя установить с точностью, однако, когда будет достигнута адсорбционная емкость, тяжелые металлы начнут поступать в воду. Но ещё задолго до наступления насыщения осадка тяжелые металлы из отложений могут переходить в воду, оказывая вредное воздействие на окружающую среду. Частично этот процесс наблюдается в половодье, при таянии снегов, когда бурные потоки воды уносят донные отложения. Например в Неккаре в половодье в воде обнаружено в 10 раз больше тяжелых металлов, чем в обычное время.
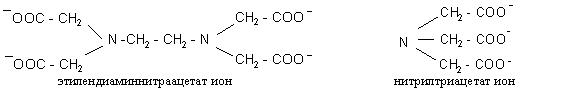 Если рН воды значительно меньше 7, то осажденные тяжелые металлы могут перейти в воду. Значение рН уменьшается при попадании кислот в реки и в сильно заросших водоемах, когда в результате активной деятельности растущих микроорганизмов выделяется особенно много СО2. При переходе металлов в воду происходит также образование хелатов с ионами этилендиаминтетраацетата и нитрилтриацетата, которые содержатся в очищающих и моющих средствах:
Если рН воды значительно меньше 7, то осажденные тяжелые металлы могут перейти в воду. Значение рН уменьшается при попадании кислот в реки и в сильно заросших водоемах, когда в результате активной деятельности растущих микроорганизмов выделяется особенно много СО2. При переходе металлов в воду происходит также образование хелатов с ионами этилендиаминтетраацетата и нитрилтриацетата, которые содержатся в очищающих и моющих средствах:
Наряду с этими давно известными путями попадания в воду тяжелых металлов существуют и другие. Обнаружены реакции, в результате которых тяжелые металлы
становятся растворимыми в воде либо в липидах (жирах и маслах), проникая затем в живые организмы и включаясь в цикл питания.
Например, было обнаружено, что в морских анаэробных условиях, т.е. в отложениях отмерших водорослей, ртуть и олово, присоединяя водород, переходят в летучие соединения. Такого рода гидрирование может осуществляться и с другими тяжелыми металлами. Эти реакции показывают, что на отдельных участках моря, покрытых обильной растительностью, покров из водорослей не только угрожает морским обитателям, но и повышает активность тяжелых металлов, переводя их в форму летучих гидридов, в которой они попадают в воду:
Sn + 2H2 → SnH4
Марганец при окислении выпадает в виде нерастворимого МпО2 , который в анаэробных условиях, вероятно, с помощью микроорганизмов переходит в растворимый в воде ион Mn2+;
MnO2 +4H+ + 2![]() → Mn 2+ + 2H2O
→ Mn 2+ + 2H2O
Хотя марганец и относится к числу жизненно необходимых элементов, однако лишь при следовых его концентрациях в организме он может участвовать в качестве переносчика электронов в окислительно-восстановительных реакциях. При высоких концентрациях этот элемент токсичен.
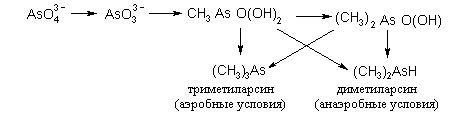 |
Для некоторых тяжелых металлов установлена возможность микробиологического алкилирования, таким образом, они могут включаться в цикл питания. У мышьяка наблюдается переход арсената в арсенит, а затем при метилировании в метилмышьяковую и диметилмышьяковую кислоту. В аэробных условиях образуются триметиларсин, в анаэробных – диметиларсин:
При участии микробов возможно метилирование соединений олова (IV) с образованием диметил- и триметилоловохлоридов. Металлическая ртуть может метилироваться в две стадии:
Hg → CH3Hg → (CH3)2Hg
Как ионы метилртути, так и диметилртуть легко поглощаются морскими и речными организмами.
Ещё не установлено, связано ли появление алкилсвинцовых соединений в организмах с микробиологическими процессами, его причиной может быть и тетраэтилсвинец, содержащийся в этилированном бензине, который используется в качестве автомобильного топлива.
Совсем другой путь для попадания в цепь питания обнаружен у кадмия и некоторых других тяжелых металлов. Кадмий может замещать цинк в цинкосодержащих ферментах (гидроксилазах). После этого фермент становится неактивным, а организмы, в которые попал кадмий, могут служить пищей для других организмов, таким образом, Cd внедряется в общую цепь питания.
Экологическое значение тяжелых металлов или других устойчивых токсинов в цепи питания можно продемонстрировать на примере ртути, первого металла, для которого было обнаружено биоконцентрирование.
В 1953 году в Японии у 121 жителя побережья в бухте Минамата было обнаружено заболевание, сопровождавшееся ломотой в суставах, нарушением слуха и зрения.
Это заболевание, вошедшее в литературу под названием «болезнь Минамата», закончилось смертью для почти трети больных. Интенсивное расследование позволило установить, что на ацетиленовом производстве ртутные отходы сбрасывались в реку, впадающую в бухту Минамата.
Ртуть, о чем первоначально и не подозревали, микробиологическим путем превращалась в метилртуть, которая через планктон, моллюсков и рыб, в конце концов, попадала на стол и в пищу. В этом цикле ртуть постепенно концентрировалась и в конце цепи, дойдя до человека, достигла токсичной концентрации. Такого рода аккумуляция возможна только тогда, когда токсин поступает в организм быстрее, чем выводится из организма.