Изохорный процес:. V = const. Работа равна нулю: dA = 0, поэтому все тепло, сообщаемое газу, идет на изменение внутренней энергии dQ = dU.
 Согласно формуле (8.9)
Согласно формуле (8.9) ![]() , а для произвольной массы газа изменение внутренней энергии равно:
, а для произвольной массы газа изменение внутренней энергии равно:
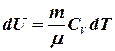 (8.12)
(8.12)
График изохорного процесса изображен на рис. 8.2: процесс 1-2 – изохорное нагревание, процесс 1-3 – изохорное охлаждение.
Изобарный процесс: p = const. Применив формулу (8.5), получаем выражение для работы (А):
![]() . (8.13)
. (8.13)
Так как внутренняя энергия равна:U=U(T) (формула состояния), то при p = const изменение dU такое же, как при V=const:
 или
или 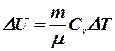 .
.
Из первого начала термодинамики (8.3) и выражений (8.12) и (8.13), получим:
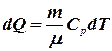 или
или 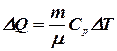 . (8.14)
. (8.14)
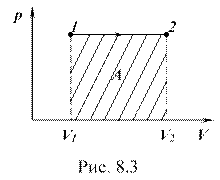
График изобарного процесса изображен на рисунке 8.3, где 1-2 – процесс расширения газа при р = const. Заштрихованная площадь равна работе газа в этом процессе.
 Изотермический процесс: T = const. Внутренняя энергия газа U=U(T) – функция состояния. Поэтому в изотермическом процессе изменение внутренней энергии равно нулю:
Изотермический процесс: T = const. Внутренняя энергия газа U=U(T) – функция состояния. Поэтому в изотермическом процессе изменение внутренней энергии равно нулю:
![]() . (8.15)
. (8.15)
Применив формулу (8.5), получим формулу работы:
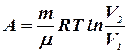 или
или 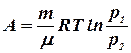 (8.16)
(8.16)
Из уравнения (8.2) следует, что теплота равна:
![]() . (8.17)
. (8.17)
Теплоемкость в изотермическом процессе равна:
![]() .
.
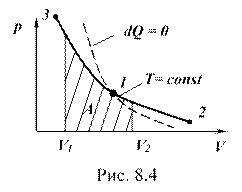
График изотермического процесса изображен на рис. 8.4 сплошной линией: 1-2 – процесс изотермического расширения; 1-3 – процесс изотермического сжатия; заштрихованная площадь равна работе в изотермическом процессе.
 Адиабатический процесс: dQ =0. Адиабатическим называется процесс, при котором отсутствует теплообмен. Используя уравнение Клапейрона-Менделеева и первое начало термодинамики, можно получить уравнение адиабатического процесса, которое называется также уравнением Пуассона:
Адиабатический процесс: dQ =0. Адиабатическим называется процесс, при котором отсутствует теплообмен. Используя уравнение Клапейрона-Менделеева и первое начало термодинамики, можно получить уравнение адиабатического процесса, которое называется также уравнением Пуассона:
![]() . (8.18)
. (8.18)
Здесь ![]() – коэффициент Пуассона, который равен:
– коэффициент Пуассона, который равен:
![]() . (8.19)
. (8.19)
При переходе к другим параметрам газа, уравнение адиабаты можно получить в виде:
![]() или
или ![]() (8.20)
(8.20)
Первое начало термодинамики для адиабатического процесса имеет вид: ![]() , то есть газ совершает работу за счет изменения внутренней энергии. Работа в этом процессе равна:
, то есть газ совершает работу за счет изменения внутренней энергии. Работа в этом процессе равна:
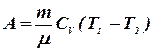 . (8.21)
. (8.21)
Теплоемкость в адиабатном процессе вычисляется по формуле: ![]() .
.
График процесса изображен на рисунке 8.4 штриховой линией. Видно, что адиабата круче, чем изотерма. Это объясняется тем, что в изотермическом процессе давление изменяется только при изменении объема, а в адиабатном процессе давление зависит еще и от температуры.