Окисление озоном позволяет одновременно обеспечить обесцвечивание воды, устранение привкусов и запахов и обеззараживание. Озонированием можно очищать сточные воды от фенолов, нефтепродуктов, сероводорода, соединений мышьяка, ПАВ, цианидов, красителей, канцерогенных ароматических углеводородов, пестицидов и др.
Озон – газ бледно-фиолетового цвета. В природе находится в верхних слоях атмосферы. При температуре минус 111,9 °С озон превращается в нестойкую жидкость темно-синего цвета. Чистый озон взрывоопасен, так как при его разложении высвобождается значительное количество тепла; очень токсичен. Максимальная допустимая концентрация в воздухе рабочей зоны равна 0,0001 мг/м3. Обеззараживающее действие озона основано на высокой окислительной способности, обусловленной легкостью отдачи им активного атома кислорода (О3 = О2 + О). Озон окисляет все металлы, кроме золота, превращая их в оксиды.
В водном растворе озон диссоциирует быстрее, чем в воздухе; очень быстро диссоциирует в слабощелочных растворах. В кислотных растворах озон проявляет большую стойкость. В чистом сухом воздухе он разлагается очень медленно. При обработке воды озоном происходит разложение органических веществ и обеззараживание воды; бактерии погибают в несколько тысяч раз быстрее, чем при обработке воды хлором. Растворимость озона в воде зависит от pH и содержания в воде растворенных веществ. Небольшое содержание кислот и нейтральных солей увеличивает растворимость озона в воде. Присутствие щелочей снижает растворимость О3.
Действие озона в процессах окисления может происходить в трех различных направлениях:
1) непосредственное окисление, с участием одного атома кислорода;
2) присоединение целой молекулы озона в окисляемое вещество, с образованием озонидов;
3) каталитическое усиление окисляющего воздействия кислорода, присутствующего в озонированном воздухе.
Озон подают в сточную воду в виде озоно-воздушной или озоно-кислородной смеси. Концентрация озона в смеси – около 3 %. Для усиления процесса окисления смесь диспергируют в сточной воде на мельчайшие пузырьки газа. Озонирование представляет собой процесс абсорбции, сопровождаемый химической реакцией в жидкой фазе. Расход озона, необходимого для окисления загрязнений, может быть определен по уравнению массообмена:
M = β′жFΔж,
где М – расход озона, переходящего из газовой фазы в жидкую, кг/с; β’ж – коэффициент массоотдачи в жидкой фазе при протекании в ней химической реакции м/с; F – поверхность контакта фаз; м2; Δж – движущая сила процесса, кг/м3.
Озон получают из кислорода воздуха под действием электрического разряда в генераторах. Перед подачей воздуха или чистого кислорода в генератор его предварительно осушают, так как с увеличением влажности воздуха выход озона уменьшается. Расход энергии на производство 1 кг озона из атмосферного воздуха составляет около 18 кВт∙ч; из кислорода – около 9 кВт∙ч.
Для озонирования промышленных сточных вод используют аппараты различных конструкций (рис. 4.22). Могут быть использованы также барботажные, насадочные и тарельчатые колонны.
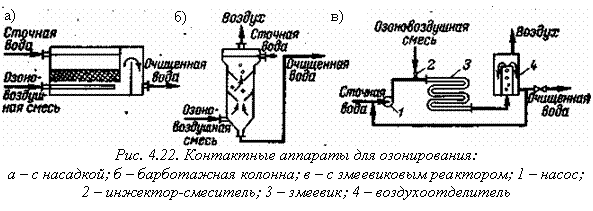
Процесс очистки сточных вод значительно сокращается при совместном использовании ультразвука и озона, ультрафиолетового облучения и озона. Ультрафиолетовое (УФ) облучение ускоряет окисление в 102…104 раз. Процесс окисления можно разделить на две стадии: фотохимическое возбуждение молекул под действием УФ-облучения, окисление озоном. На первой стадии образуются высокоактивные в отношении озона свободные радикалы и соединения с низкой молекулярной массой, которые, поглощая свет, окисляются быстрее, чем исходные.