Если газ находится в равновесном состоянии, то его молекулы движутся беспорядочно и хаотично. Все направления движения равновероятны, а скорости по величине различны, но очень большие и очень малые скорости маловероятны. В основном все скорости группируются в каком-то среднем интервале вблизи некоторых значений, называемых наиболее вероятной (v6), средней арифметической (<v>) и средней квадратичной (![]() ) скоростями.
) скоростями.
Средняя арифметическая скорость равна:
![]() (7.3)
(7.3)
где ![]() – число молекул,
– число молекул, ![]()
![]() ,… – скорости этих молекул.
,… – скорости этих молекул.
Средняя квадратичная скорость вычисляется по формуле:
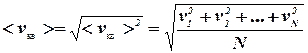 (7.4)
(7.4)
С наибольшей вероятностью будут осуществляться состояния, при которых энергии различных молекул газа (![]() ): сравнительно близки друг к другу и мало отличаются от их среднего значения. Средняя энергия поступательного движения одной молекулы идеального газа равна:
): сравнительно близки друг к другу и мало отличаются от их среднего значения. Средняя энергия поступательного движения одной молекулы идеального газа равна:
![]() , (7.5)
, (7.5)
где ![]() – масса одной молекулы.
– масса одной молекулы.