Реакции осаждения наиболее часто используются в аналитической химии для идентификации и определения катионов и анионов. Осаждение проводят следующим образом: к нескольким каплям исследуемого раствора, обычно в центрифужной пробирке, прибавляют пипеткой (не касаясь стенок пробирки!) указанное число капель реагента, предварительно создав надлежащие условия. Затем содержимое пробирки тщательно перемешивают стеклянной палочкой и, если нужно, нагревают на водяной бане.
При использовании реакций осаждения для обнаружения ионов нет необходимости в том, чтобы осаждение было количественным. Часто достаточно одной капли реа
гента, чтобы можно было судить о присутствии или отсутствии того или иного иона. Одним из универсальных осадителей являются гидроксид-ионы. Задача осаждения гидроксидов металлов сводится к созданию и поддержанию определенного значения рН среды.
Для осаждения гидроксидов металлов обычно используют гидроксиды натрия (калия), аммиак. Нередко образование гидроксидов металлов наблюдается и при действии солей слабых кислот, таких, как карбонат натрия (калия), карбонат аммония, сульфид аммония. Вследствие гидролиза их растворы имеют щелочную реакцию. Поэтому, если растворимость гидроксида меньше, чем растворимость карбоната или сульфида, то при действии данных реагентов выпадает гидроксид.
Методы осаждения основаны на применении реакций осаждения, связанных с образованием малорастворимых соединений. Эти методы дают возможность количественно определять анионы, осаждаемые катионами Ag+, Ba2+, Hg+, Pb2+, Zn2+ и др., а также катионы, образующие малорастворимые соединения с Cl-, Br-, I-, CN-, SCN-, SO42-, CrO42-, PO43-, [Fe(CN)6]3- и др.
В растворе соединения KtaAnb произведение активностей катионов и анионов (ПР) сохраняется неизменным, строго определенным:
![]() .
.
Условием выпадения осадка из раствора является выполнение неравенства:
![]() ,
,
т.е. растворимость электролита приобретает максимальное значение в насыщенном растворе, свободном от посторонних ионов. Если исходная концентрация ионов А до осаждения равна сА, а равновесная концентрация после осаждения равна [A], то:
![]() , (7.2)
, (7.2)
где L – равновесная концентрация осадителя.
Подставим уравнение (7.2) в уравнение (7.1), получим:
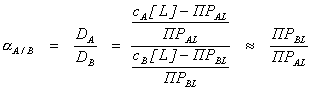 .
.
Иногда растворы содержат настолько малые количества анализируемого вещества, что при любых концентрациях осадителя условие выпадения осадка соблюдаться не будет. В таких случаях в раствор вводят посторонний катион (или анион) и осаждают его соответствующим реагентом. На осадке в процессе его образования соосаждаются следы определяемых ионов.
Соосаждение с неорганическими и органическими соосадителями представляет собой один из эффективных способов концентрирования элементов. Причин соосаждения может быть несколько: окклюзия, адсорбция, образование твердых растворов, внесение центров кристаллизации, ионообменные процессы.