В зависимости от соотношения энергии теплового движения частиц (атомов, ионов или молекул), образующих данное вещество, и энергии их взаимодействия все материалы при нормальных условиях могут находиться в газообразном, жидком или твердом состоянии. Особым видом существования вещества является плазменное состояние, которое образуется при высоких температурах (выше 5000°С) или при воздействии электрических разрядов и представляет собой сильно ионизированный газ. Переход вещества из газообразного состояния в жидкое и далее в твердое сопровождается ростом упорядоченности в расположении частиц в пространстве.
Вещества находятся в газообразном состоянии тогда, когда энергия теплового движения частиц превышает энергию их взаимодействия. Такими частицами в газах являются молекулы: реже одноатомные (Не, Ne, Аr, Кr, Хе, Rn), чаще двух-, трех- и многоатомные (Н2, О2, СО2, Н2О, СН4, С2Н6 и т.п.). Молекулы газа находятся в постоянном хаотическом движении. Под действием внешних энергетических воздействий незначительная часть молекул ионизирует с образованием ионов и электронов.
В жидком состоянии энергия теплового движения частиц, образующих вещество, сравнима с энергией их взаимодействия. В диэлектриках этими частицами являются молекулы, которые образуют неустойчивые комплексы, непрерывно распадающиеся и вновь образующиеся. Если молекулы полярные, то часть их будет диссоциирована на положительные и отрицательные ионы. В жидкостях имеет место ближний порядок – некоторая закономерность в расположении частиц, находящихся в непосредственной близости.
Неионизированные газы и недиссоциированные жидкости являются диэлектриками. Сильно ионизированные газы (плазма), расплавы и водные растворы электролитов представляют собой проводники второго рода.
В твердом состоянии энергия взаимодействия частиц, образующих вещество, значительно превышает энергию их теплового движения. Такими частицами являются атомы, ионы или молекулы, которые расположены либо в геометрически правильном порядке, образуя кристаллическое тело, либо хаотически, в беспорядке, образуя аморфное тело.
В аморфных телах в расположении частиц (атомов, ионов или молекул) наблюдается только ближний порядок. Аморфные тела проявляют изотропность физических свойств. Строение твердых тел, находящихся в аморфном состоянии, сходно со строением жидкостей. Для них, в отличие от жидкостей, характерна очень высокая вязкость.
В кристаллическом теле наблюдается как ближний, так и дальний порядок расположения частиц, т.е. частицы размещаются в пространстве на определенном расстоянии друг от друга в геометрически правильном порядке, образуя кристалл. В кристалле сформирована пространственная кристаллическая решетка. Многократно повторяющимся элементом решетки является элементарная (кристаллографическая) ячейка, вершины которой называют узлами, а расстояние между двумя соседними узлами – периодом или постоянной решетки (рис. 1.1).
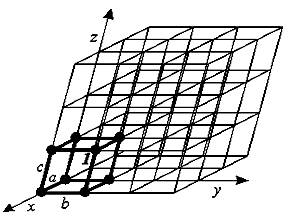
Рис. 1.1. Модель кристаллической решетки
Каждое вещество имеет кристаллы определенной формы, которая отражает их внутреннее строение. Форма кристаллов определяется величиной периодов а, b, с и осевых углов (рис. 1.1). Геометрически возможны лишь четырнадцать различных пространственных решеток, образующих семь кристаллографических систем (сингоний).
Наиболее распространены кристаллические решетки следующих типов:
· объемно центрированная кубическая (ОЦК);
· гранецентрированная кубическая (ГЦК);
· гексагональная, которая бывает плотноупакованная (ГПУ) и неплотноупакованная.
Подавляющее большинство металлов имеет отмеченные типы кристаллических решеток (рис. 1.2). Менее распространены ромбоэдрическая, тетрагональная и более сложные решетки.
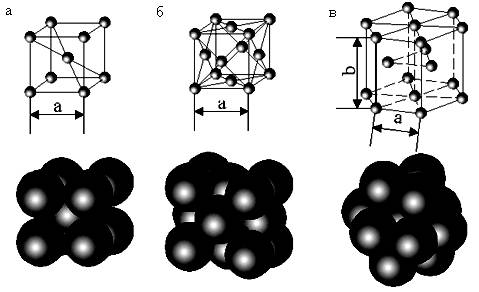
Рис. 1.2. Расположение атомов в кристаллической решетке:
а – объемно центрированной кубической; б – гранецентрированной кубической; в – гексагональной плотноупакованной
Кристаллическую решетку характеризуют следующие основные параметры:
· период решетки;
· атомный радиус;
· энергия кристаллической решетки;
· координационное число;
· базис решетки;
· коэффициент компактности.
Периодом решетки называется расстояние между центрами двух соседних частиц (атомов, ионов) в элементарной ячейке решетки.
Под атомным радиусом понимают половину межатомного расстояния между центрами ближайших атомов в кристаллической решетке элемента при нормальной температуре и атмосферном давлении. Однако атомный радиус не является постоянной величиной, а изменяется в зависимости от ряда факторов, важнейшими из которых являются координационное число и тип химической связи между атомами в кристалле.
Энергия кристаллической решетки определяется как энергия, выделяющаяся при образовании кристалла из ионов, атомов или других частиц, образующих кристалл, когда исходное состояние этих частиц газообразное. От величины энергии решетки зависят такие свойства вещества, как температура плавления, модуль упругости, прочность, твердость и др. Увеличение валентности атомов приводит к увеличению энергии решетки.
Координационное число (К), показывает количество атомов, находящихся на наиболее близком и равном расстоянии от любого выбранного атома в решетке.
Базисом решетки называется количество атомов, приходящихся на одну элементарную ячейку решетки.
Коэффициент компактности (η) решетки определяется отношением объема, занимаемого атомами (Va), ко всему объему решетки (Vp), т.е.
![]()
При рассмотрении схемы элементарных ячеек (см. рис. 1.2) выясняется, что плотность упаковки атомов в разных плоскостях и по разным направлениям в кристалле разная. Поэтому и свойства кристаллического тела в разных направлениях будут разные. Такое явление, когда свойства вещества зависят от направления, называется анизотропией. Это свойство кристаллических тел широко используется в технике.
В зависимости от того, какие частицы (атомы, ионы или молекулы) находятся в узлах решетки, различают следующие основные типы кристаллических структур: атомные, металлические, ионные и молекулярные. Характерная особенность кристаллических тел – анизотропия их свойств, которая значительно проявляется только у монокристаллов и слабо – у текстурированных материалов.

Рис. 1.3. Структура поликристаллического твердого тела:
а – схематическое изображение; б – микрошлиф
Монокристалл – это огромное число одинаково ориентированных элементарных ячеек, т.е. это большой одиночный кристалл. В природе некоторые минералы встречаются в виде монокристалов. Однако большинство кристаллических веществ являются поликристаллическими. Они состоят из множества сросшихся мелких кристаллов, не имеющих одинаковой ориентации, и поэтому проявляют изотропность физических свойств. При кристаллизации кристаллы сталкиваются друг с другом и теряют правильную геометрическую форму. Такие кристаллы называют кристаллическими зернами, просто зернами или кристаллитами (рис. 1.3). Они малы, и в обычных металлах их можно увидеть только в микроскоп.
Текстурирование – это некоторая упорядоченность в ориентации кристаллических зерен, достигаемая специальной обработкой (например, прокаткой) поликристаллических материалов.