Сплавы на основе железа (стали и чугуны) и в настоящее время остаются основными конструкционными материалами. Более 90 % деталей изготовляется из этих материалов. Поэтому изучению сплавов на железной основе отводится ведущее место.
 Так как во всех технических сплавах на основе железа имеется углерод, то изучение сплавов начинают с изучения строения и свойств железа и углерода и соединения железа с углеродом, так как углерод находится в большинстве сплавов.
Так как во всех технических сплавах на основе железа имеется углерод, то изучение сплавов начинают с изучения строения и свойств железа и углерода и соединения железа с углеродом, так как углерод находится в большинстве сплавов.
 Железо. Для железа характерен смешанный тип связей между атомами, что проявляется в высокой температуре плавления и высоком значении модуля упругости. Сплавы на его основе имеют высокий модуль упругости, обеспечивают высокую жесткость деталей изготовленных из этих сплавов.
Железо. Для железа характерен смешанный тип связей между атомами, что проявляется в высокой температуре плавления и высоком значении модуля упругости. Сплавы на его основе имеют высокий модуль упругости, обеспечивают высокую жесткость деталей изготовленных из этих сплавов.
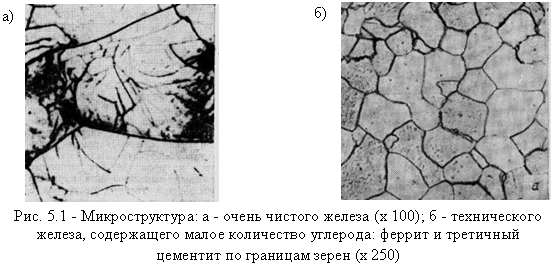
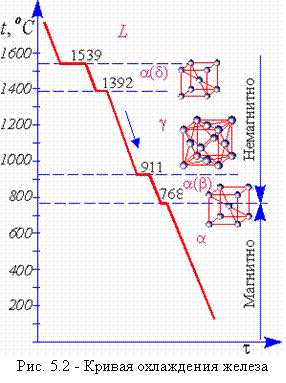
Абсолютно чистое железо неизвестно. Технически чистым считается железо (ок. 99,85 % Fe) с содержанием примесей 0,1…0,2 %, в том числе 0,02…0,05 % С (рис. 5.1). Такое железо называется армко-железо и производится для электротехнических целей в большом количестве. Железо кристаллизуется при 1539 °С (рис. 5.2) и имеет полиморфные превращения при двух температурах: 1392 и 911 °С.
При температурах ниже 911 °С существует Feα с решеткой ОЦК В интервале температур 911 и 1392 °С устойчиво Feγ, с решеткой ГЦК Выше 1392 °С до температуры плавления (1535 ± 9) °С железо снова имеет решетку ГЦК и называется Feδ. Ниже 768 °С железо ферромагнитно, выше – парамагнитно (точка Кюри железа).
Железо со многими элементами образует твердые растворы. С водородом, азотом и углеродом железо образует твердые растворы внедрения.
Особо следует рассмотреть образование растворов углерода в железе. Растворимость углерода в железе существенно зависит от того, в какой кристаллической форме существует железо. Растворимость углерода в α-железе ничтожно мала (менее 0,02 %) и в сто раз больше (до 2,14 %) в γ-железе.
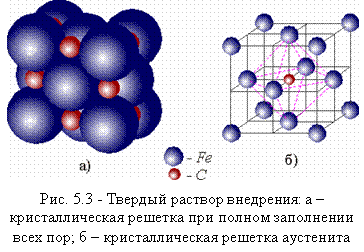 Твердый раствор углерода и других элементов в α-железе называется ферритом, а в γ-железе – аустенитом. Кристаллическую структуру аустенита можно себе представить как ГЦК решетку, состоящую из атомов железа, в которую внедрены атомы углерода. Если бы все свободные места (поры) в ГЦК решетке были заняты углеродом, то это состояние характеризовала бы схема, изображенная на рис. 5.3, а. Но так как атом углерода больше размеров поры, то при попадании его в решетку железа последняя искажается, и остальные поры становятся недоступными для других атомов углерода (рис. 5.3, б).
Твердый раствор углерода и других элементов в α-железе называется ферритом, а в γ-железе – аустенитом. Кристаллическую структуру аустенита можно себе представить как ГЦК решетку, состоящую из атомов железа, в которую внедрены атомы углерода. Если бы все свободные места (поры) в ГЦК решетке были заняты углеродом, то это состояние характеризовала бы схема, изображенная на рис. 5.3, а. Но так как атом углерода больше размеров поры, то при попадании его в решетку железа последняя искажается, и остальные поры становятся недоступными для других атомов углерода (рис. 5.3, б).
Со многими элементами железо образует металлические соединения, с углеродом и азотом железо образует фазы внедрения, карбиды, нитриды, которые сильно упрочняют сплавы на основе железа.
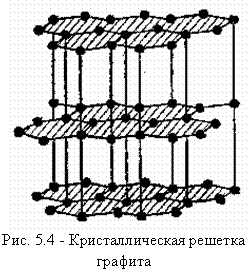 Углерод. Углерод обладает свойством полиморфного превращения: имеет гексагональный тип решетки (графит) (рис. 5.4, см. рис. 1.2) или решетку с координационным числом 4 (типа алмаза) (см. рис. 1.4).
Углерод. Углерод обладает свойством полиморфного превращения: имеет гексагональный тип решетки (графит) (рис. 5.4, см. рис. 1.2) или решетку с координационным числом 4 (типа алмаза) (см. рис. 1.4).
В виде графита углерод находится в сплавах железа типа чугунов (рис. 5.5). Температура плавления графита ~ 3500 °С, плотность – 2,5 г/см3. В сплавах железа с углеродом углерод находится в состоянии твердого раствора с железом и в виде химического соединения Fe3С – цементита (карбида железа) – содержит 6,67 % С.
Цементит. Кристаллическая решетка цементита состоит из ряда октаэдров, оси которых наклонены друг к другу. В вершинах октаэдров находятся атомы железа, каждый из которых одновременно принадлежит двум октаэдрам; атом углерода находится в центре октаэдра.
Характер связи между атомами углерода и железа в цементите точно не установлен. Однако в кристаллах цементита железо и углерод положительно ионизированы, благодаря чему цементит характеризуется некоторыми металлическими свойствами (электропроводностью, металлическим блеском).
 Цементит очень твердый (> 800 НВ) и весьма хрупкий. Температура плавления цементита точно не установлена. Атомы железа в цементите могут замещаться атомами некоторых других металлов. В этом случае образуется легированный цементит. Углерод в цементите практически не растворяется.
Цементит очень твердый (> 800 НВ) и весьма хрупкий. Температура плавления цементита точно не установлена. Атомы железа в цементите могут замещаться атомами некоторых других металлов. В этом случае образуется легированный цементит. Углерод в цементите практически не растворяется.
Цементит – соединение неустойчивое и в определенных условиях может разлагаться на железо и углерод в виде графита, что имеет большое значение в процессе структурообразования чугуна.