Ответим теперь на вопросы:
· от чего зависит растворимость вещества;
· почему одни вещества чрезвычайно малорастворимы, другие растворимы умеренно, а третьи хорошо растворимы?
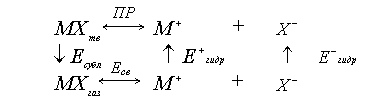 |
Для малорастворимого вещества, являющегося сильным электролитом, можно записать следующий циклический процесс:
Так как ![]() , то
, то
![]() ,
,
![]() ,
,
где Есубл – энергия сублимации кристалла (энергия кристаллаческой решетки), Есв – энергия химической связи, Е+гидр – энергия гидратации катиона, Е-гидр – энергия гидратации аниона.
Если величина DG отрицательна, процесс будет идти самопроизвольно. В свою очередь, она состоит из энтальпийной и энтропийной составляющей. Первую можно было бы рассчитать, используя приведенное уравнение для ΔН, однако отдельные составляющие правой части уравнения, как правило, неизвестны и с трудом поддаются оценке. Ясно только одно, что значение и знак DН растворения определяются разницей между энергией гидратации, с одной стороны, и энергией сублимации и энергией связи – с другой.
Несравнимо проще экспериментально определить DН растворения, используя установки, которые называются калориметрическими. Что касается энтропийной составляющей, то, на первый взгляд, DS при растворении должна быть положительна, поскольку раствор является менее упорядоченной системой, по сравнению с твердым телом, но, с другой стороны, процессы гидратации ведут к упорядочению молекул растворителя, хотя бы частично, что приводит к убыли энтропии. При таком положении дел количественно предсказать растворимость твердых веществ сложно.
Познакомившись с процессом выделения осадков, мы можем сформулировать требования, которые предъявляются к ним в аналитической химии. В анализе различают осаждаемую и весовую форму осадка. Осаждаемая форма – это тот осадок, в виде которого производится осаждение. Весовая форма – это тот осадок, в виде которого производится взвешивание.
Осаждаемая форма должна быть:
· малорастворимой (S < 10-5 моль/л);
· свободной от загрязнений;
· легко фильтруемой;
· легко превращаемой в весовую форму.
Весовая форма должна:
· иметь точную стехиометрию,
· быть инертной по отношению к компонентам среды, в которой производится определение,
· иметь малый коэффициент (фактор) пересчета.
Допустим, нам нужно определить кальций весовым способом, причем в присутствии магния. Кальций можно осадить в виде: CaC2O4, CaCO3, CaSO4, Ca(OH)2. Две последние формы отпадают, поскольку они имеют значительную растворимость. Оксалат кальция не подходит, потому что его загрязняет оксалат магния, если не предпринимаются специальные меры.
Остается карбонат кальция. Он имеет малую растворимость, в присутствии солей аммония магний не осаждается в виде карбоната, cтало быть, возможно получение чистого осадка. Осадок кристаллический. При правильных приемах осаждения можно получить легко фильтруемый осадок и, наконец, легко может быть превращен в одну из весовых форм: CaCO3, CaSO4, CaO.
Карбонат кальция в качестве весовой формы малопригоден из-за наличия равновесия ![]() при повышенных температурах. Окись кальция гигроскопична, а также реагирует с углекислым газом воздуха. Сульфат кальция имеет строго стехиометричный состав, устойчив при высоких температурах, негигроскопичен и к тому же легко получается из осаждаемой формы действием концентрированной серной кислоты с последующим прокаливанием.
при повышенных температурах. Окись кальция гигроскопична, а также реагирует с углекислым газом воздуха. Сульфат кальция имеет строго стехиометричный состав, устойчив при высоких температурах, негигроскопичен и к тому же легко получается из осаждаемой формы действием концентрированной серной кислоты с последующим прокаливанием.
Итак, осаждаем кальций в виде карбоната, отфильтровываем и промываем его, сушим, озоляем фильтр и далее действием серной кислоты переводим в сульфат, прокаливаем, охлаждаем и взвешиваем. По весу осадка находим содержание кальция в анализируемом обьекте.