Титриметрический анализ основан на титровании – процессе, при котором к анализируемой жидкой пробе постепенно добавляют раствор титранта и фиксируют объем, отвечающий завершению аналитической реакции между определяемым компонентом и титрантом. В зависимости от типа используемой реакции различают несколько
методов титриметрического анализа: кислотно-основной, окислительно-восстановительный, осадительный и комплексометрический.
В основу титриметрического анализа могут быть положены только те химические реакции, которые протекают с достаточной скоростью, количественно, в соответствии со строгой и известной стехиометрией, и для которых существует какой-либо способ фиксации конечной точки титрования.
Наиболее удобным способом изучения особенностей процессов титрования является построение диаграмм – кривых титрования. Для классического титрования они представляют собой графическую зависимость аналитического сигнала от объема прибавленного в раствор титранта или титровальной доли.
Аналитическим сигналом в кислотно-основном титровании является концентрация протонов [Н3О+|, однако на кривой титрования удобнее изображать не |Н3О+], а логарифмическую величину ![]() .
.
Аналитический сигнал в комплексометрическом и осадительном титрованиях – равновесная концентрация металла [Мn+], на кривую титрования наносят логарифмическую величину ![]() . Аналитическим сигналом в окислительно-восстановительном титровании является значение окислительно-восстановительного потенциала (Е) титруемой системы.
. Аналитическим сигналом в окислительно-восстановительном титровании является значение окислительно-восстановительного потенциала (Е) титруемой системы.
Важнейшее понятие, связанное с кривой титрования, – точка эквивалентности Цель любого титрования – достижение точки эквивалентности. В точке эквивалентности количество затраченного стандартного раствора титранта химически эквивалентно количеству реагирующего с ним вещества.
При построении кривых титрования по оси абсцисс удобно откладывать не объем титранта, а титровальную долю (D). Титровальная доля – это отношение количества титранта, израсходованного в данный момент титрования, к его количеству в точке эквивалентности. По определению в точке эквивалентности D = 1,000.
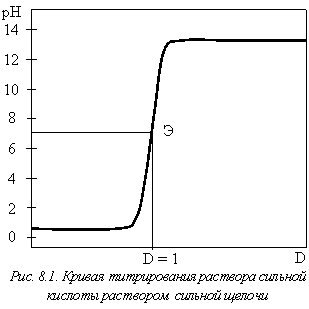 Типичная кривая кислотно-основного титрования показана на рис. 8.1. Координаты точки эквивалентности (рН = 7,00; D = 1,00) отвечают теоретическому стехиометрическому соотношению реагентов. Подобные кривые можно либо рассчитывать, либо получать экспериментально, проводя измерения рН раствора в ходе титрования с помощью рН-метра.
Типичная кривая кислотно-основного титрования показана на рис. 8.1. Координаты точки эквивалентности (рН = 7,00; D = 1,00) отвечают теоретическому стехиометрическому соотношению реагентов. Подобные кривые можно либо рассчитывать, либо получать экспериментально, проводя измерения рН раствора в ходе титрования с помощью рН-метра.
В классическом титровании величину эквивалентного объема фиксируют по изменению окраски специально введенного в систему индикатора. Идеальный индикатор имеет интервал перехода окраски, в середине которого находится значение рН, Е или рМ, отвечающее точке эквивалентности. На практике такие идеальные условия не достигаются. Реально фиксируют объем титранта в конечной точке титрования, положение которой не совпадает с точкой эквивалентности.
Для рассмотренного примера (рисю 8.1) можно использовать несколько индикаторов, интервал перехода окраски которых (рТинд) отличается от области рН = 7,0 в ту или иную сторону. Однако из-за большой величины скачка рН в области точки эквива
лентности это несовпадение вносит малую погрешность при правильно подобранном индикаторе. Если выбор индикатора сделан неквалифицированно, то погрешность титрования может достичь очень большого значения, вплоть до 100 %.
При наличии соответствующей аналитической реакции точность титриметрического метода анализа определяется погрешностями измерения объема титранта, титруемого вещества и погрешностью определения концентрации раствора титранта.
Раствор титранта с точно известной концентрацией, применяемый для титрования, называют стандартным раствором. Во всех методах титриметрического анализа используют два типа стандартных растворов: первичных и вторичных стандартов.
Растворы первичных стандартов. Их готовят растворением точной навески стандартного вещества, используемого в качестве титранта, в мерной колбе и доведением ее объема до метки. Для исключения систематической погрешности колбу обычно калибруют. Для приготовления растворов можно использовать «стандарт-титры», которые представляют из себя запаянные стеклянные ампулы, содержащие точно отмеренное количество стандартного вещества.
Первичным стандартом являются только те вещества, которые отвечают следующим требованиям:
1) состав соединения должен строго соответствовать химической формуле;
2) вещество должно быть химически чистым;
3) вещество должно быть устойчивым как в твердом виде, так и в растворе;
4) вещество должно обладать, по возможности, большой эквивалентной массой.
Растворы вторичных стандартов. Их готовят в больших склянках, примерно необходимой концентрации. Точная концентрация таких растворов устанавливается методом титрования известной навески стандартного вещества. Процесс определения концентрации титранта при этом называют стандартизацией.